心肌重塑是多种心血管疾病共同的病理改变, 在心肌重塑过程中除心肌细胞肥大、心肌纤维排列紊乱外, 还常伴有心肌成纤维细胞的增殖及活化。活化的心肌成纤维细胞通常有更强的运动、迁移能力, 并合成大量胶原, 破坏心脏的正常结构, 导致心脏功能紊乱, 因此, 采用药物阻断心肌成纤维细胞的增殖及活化可能是阻断、甚至逆转心肌重塑的有效策略。
粉防己碱(tetrandrine, Tet)是从防己科植物粉防己中提取的一种天然有机化合物[1]。在我国, Tet被用于治疗肝纤维化、高血压、类风湿关节炎、恶性肿瘤以及矽肺病等[2]。Tet可以抗高血压、抗纤维化、抗炎症, 在治疗矽肺病患者时发现Tet可显著抑制胶原的沉积[3]。在动物实验中, Tet能够有效抑制高血压和冠状动脉缺血状态下的心肌重塑[4, 5, 6]。然而, Tet对心肌重塑特别是心肌成纤维细胞的作用机制并不十分清楚, 因此, 本研究以原代新生大鼠心肌成纤维细胞为模型, 观察Tet对心肌成纤维细胞增殖及活化的影响, 以此探讨Tet作为一种心肌重塑抑制剂的可行性, 为心肌重塑的治疗提供新方法。
取出生后1~3 d的SD乳大鼠(购自北京维通利华实验动物有限公司), 消毒后经胸骨处剪开并取出心脏, 清洗后将心脏剪成小块, 采用0.06%(质量分数)胶原酶Ⅱ 消化液于37 ℃下不断震荡消化10 min。之后, 将上清液加入到含有20%(体积分数)胎牛血清(fetal bovine serum, FBS)的达尔伯克改良伊格尔培养基(Dulbecco’ s modified Eagle me-dium, DMEM)中, 反复颠倒以终止消化, 共收集约5~6次, 直到组织块消化为白色絮状物为止。将收集到的上清液以1 000 r/min离心5 min, 弃上清, 并用含有10%(体积分数)FBS的DMEM培养基悬浮沉淀物, 用300目滤网过滤, 并在培养皿中培养, 于37 ℃孵箱内孵育90 min差速贴壁。将上清液弃去, 并用磷酸盐缓冲液(phosphate buffered saline, PBS)反复漂洗已贴壁的细胞2~3次, 直至镜下观察无悬浮细胞为止。用0.05%(质量分数)的胰酶消化液消化细胞, 并用含有10%FBS的DMEM培养基终止消化, 收集入离心管中, 用1 000 r/min离心5 min后弃去上清。之后, 用含有10%FBS的DMEM培养基悬浮沉淀物, 再次差速贴壁90 min, 用同样的方法漂洗贴壁细胞, 用含有10%FBS的DMEM培养基悬浮贴壁细胞, 并稀释至相应浓度后, 接种至相应孔板内孵育24 h, 之后换为含有1% FBS的DMEM培养基再次培养 24 h后用于实验。为探讨Tet对心脏成纤维细胞的作用, 我们分别采用0.5、1、2、4和8 μ mol/L的Tet处理心肌成纤维细胞48 h。
将心肌成纤维细胞吹打呈单细胞悬液, 接种于96孔板, 每孔约5 000个细胞, 并置于37 ℃培养箱内培养, 之后加入相应浓度的Tet处理48 h。然后每孔加入10 μ L细胞计数试剂(cell counting kit-8, CCK-8), 放置于37 ℃细胞培养箱内孵育2 h, 并在酶标仪450 nm测定光密度值(D)。
将各组细胞在冰上用细胞裂解液充分裂解, 以8 000 r/min离心10 min。取上清液用二喹啉甲酸法定量, 将等量各组样品在十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)后电转至硝酸纤维素膜上, 用5%(质量分数)脱脂奶粉室温孵育1 h。采用相应的一抗[β -链蛋白:1 :1 000, 波形蛋白(vimentin, Vm):1 :1 000, 纤连蛋白(fibronectin, Fn):1 :800, 平滑肌α -肌动蛋白(smooth muscle α -actin, SMA):1 :1 000及GAPDH:1 :2 000]于4 ℃下孵育过夜。次日, 用加吐温的三乙醇胺缓冲盐水溶液(tris buffered saline+Tween, TBST)漂洗4次, 每次5 min, 并用相应辣根过氧化物酶标记的二抗(1 :5 000)室温孵育1 h。用TBST漂洗4次, 每次5 min, 用化学发光底物显影并拍照, 用Quantity One (Bio-Rad公司, 美国)软件进行灰度扫描, 以待测条带灰度值与GAPDH比值表示各组相应蛋白表达强度。
将各组细胞接种于6孔板, 经相应处理后, 每孔加入1 mL TriZol试剂(Life Technologies公司, 美国), 充分裂解后, 反复吹打, 转移至不含RNA酶的离心管中, 加入氯仿, 以12 000 r/min离心15 min。取上清液, 并加入异丙醇沉降RNA, 经乙醇洗涤、干燥后, 加入DEPC处理水溶解。采用核酸定量仪检测提取RNA的浓度和质量。之后采用逆转录酶将总RNA逆转录为cDNA, 采用荧光染料标记实时定量PCR法, 用特异性的引物检测相应基因的表达强度。以待测基因的Ct值相对于内参照的Ct值表示该基因的表达强度。各对引物序列如下:Ⅰ 型胶原(collagen-1, Col-1):正向:CACTCAGCCCTCTGTGCCT, 反向:ACCTTCGCTTCCATACTCG; Ⅲ 型胶原(collagen-3, Col-3):正向:AACCCTGCTCGGAATTGCAG, 反向:TCTGTCCACCAGTGCTTCCG; β -actin:正向:CCACTGCCGCATCCTCTT, 反向:GCATCGGAACCGCTCATT。
实验数据以均数± 标准差表示, 分析采用SPSS 19.0统计软件进行, 两样本间比较采用t检验, 多样本的比较采用单因素方差分析, 组间两两比较采用LSD检验, 以P< 0.05为差异有统计学意义。
采用CCK-8试剂检测各组细胞的增殖活力, 结果显示, 与对照组相比, 用0.5、1、2、4和8 μ mol/L的Tet处理后的心肌成纤维细胞增殖活力分别下降至对照组的94.4%、84.9%、74.9%、63.8%及50.3%, 差异有统计学意义(P=0.043, P< 0.001, P< 0.001, P< 0.001, P< 0.001)。
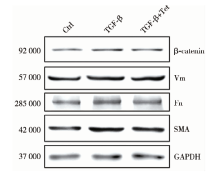
心肌成纤维细胞活化在心肌重塑过程中起到重要作用。为探讨Tet对心肌成纤维细胞是否有活化作用, 我们采用0.5 μ mol/L的Tet进行预处理1 h, 之后采用5 μ g/L的TGF-β 诱导心肌成纤维细胞活化。48 h后, 检测β -链蛋白、Vm、Fn及SMA的表达变化。Western blot(图1)灰度扫描结果显示:TGF-β 显著上调β -链蛋白、Vm、Fn及SMA的表达(P值分别为0.001、0.008、0.010、0.001), 而Tet可明显阻断TGF-β 诱导的β -链蛋白、Fn及SMA的表达上调(P值分别为0.009、0.005、0.019), 但不改变心肌成纤维细胞Vm的表达量(P> 0.05)。
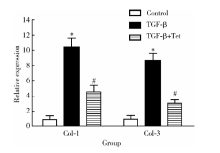
心肌成纤维细胞被激活后可合成并分泌大量胶原, 并参与心肌重构的病理过程。为检测Tet是否阻断TGF-β 诱导的胶原合成, 我们分别采用实时荧光定量PCR法对各组Col-1及Col-3表达强度进行检测, 结果 (图2) 显示:在未进行Tet处理时, TGF-β 刺激48 h可显著上调Col-1及Col-3的表达P< 0.001。而用0.5 μ mol/L的Tet处理后, TGF-β 诱导的胶原合成上调明显P< 0.001。
多种心血管疾病, 如高血压、缺血性心脏病、心脏瓣膜病和心肌病等均可导致心肌病理性重塑的发生。长期的心肌重塑最终损害心功能, 并导致心力衰竭, 严重影响患者的生存质量甚至危及生命。目前研究认为, 有多种细胞参与心肌重塑的病理过程, 当心脏受到各种病理性刺激时, 首先出现代偿性肥厚, 表现为心肌细胞的肥大和肌纤维的增粗, 但是通常这个阶段心功能尚未受损。在长期的病理因素刺激下, 心脏结构出现不可逆的排列紊乱, 并伴有心肌成纤维细胞的增殖和胶原沉积, 逐渐累及心脏功能[7, 8, 9]。心肌成纤维细胞是构成心肌组织的主要细胞之一, 占心肌组织内细胞总数的60%~70%。在心肌损伤的过程中, 心肌成纤维细胞被活化并增殖, 部分心肌成纤维细胞转化为心脏肌成纤维细胞, 其运动能力增强, 迁移至损伤部位并合成大量胶原促进损伤部位的愈合[10, 11, 12, 13]。然而, 长期的病理性刺激导致的心肌成纤维细胞持续性活化、过度增殖也是导致心肌病理性重塑的关键机制, 因此, 采用药物阻断心肌成纤维细胞的活化是心肌重塑治疗的有效方案。
Tet是一种早已被广泛应用于临床的天然提取物单体成分。在实验性肺纤维化和肝纤维化动物模型中, Tet可显著阻断胶原沉积、降低纤维化程度[14]。在肿瘤细胞中, Tet可抑制细胞增殖、诱导细胞凋亡[15, 16]。
我们的研究应用CCK-8试剂检测不同浓度Tet对成纤维细胞增殖活力的影响, 结果表明, Tet对心肌成纤维细胞的增殖亦有显著的抑制作用。
本研究中, 我们采用β 链蛋白、Vm、Fn及SMA作为观测指标评价心肌成纤维细胞的活化情况。在活化的心肌成纤维细胞中上述4种蛋白的表达均呈上调变化, 而TGF-β 是诱导成纤维细胞活化的关键性分子。添加Tet处理细胞实验结果表明, 低剂量的Tet即可显著降低TGF-β 诱导的β 链蛋白、Fn及SMA表达上调, 但是我们并未观察到Vm的表达发生明显变化, 推测可能与Tet的使用剂量有关, 后续研究将在更高浓度的Tet作用下观察对Vm表达的影响。
胶原合成增加是心肌成纤维细胞活化的另一重要特征。有报道表明TGF-β 可显著增强Ⅰ 型及Ⅲ 型胶原的合成[17, 18]。我们的研究结果证实, Tet可显著阻断心肌成纤维细胞中由TGF-β 诱导的胶原合成增加。由此推测Tet对TGF-β 诱导的心肌成纤维细胞活化有显著的抑制作用。
综合我们的实验结果, Tet能够抑制心肌成纤维细胞的增殖, 下调TGF-β 诱导的心肌成纤维细胞的活化并减少胶原合成, 据此推断Tet具有抗心肌纤维化作用, 并阻断心肌重塑, 因此Tet很可能是一种新的心肌重塑抑制药物, 但该作用尚需在体内动物实验中进一步证实。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|