目的:探讨苯并[a]芘[benzo(a)pyrene,BaP]对神经胶质细胞中具有β-淀粉体(β-amyloid,Aβ)清除作用的胰岛素降解酶(insulin-degrading enzyme,IDE)及脑啡肽酶(neprilysin,NEP)表达的影响。方法:制备新生SD大鼠原代神经胶质细胞混合培养体系,接受不同浓度的BaP、Aβ1-42寡聚体、Aβ1-42纤维体单独或联合处理24 h后,采用细胞增殖-毒性检测试剂盒测定细胞存活率。随机分为对照组、BaP(2.00 μmol/L)组、Aβ1-42(20.00 mg/L)寡聚体组、BaP+Aβ1-42寡聚体组、Aβ1-42(20.00 mg/L)纤维体组、BaP+Aβ1-42纤维体组,其中BaP均为预处理12 h后再与不同聚集状态的Aβ1-42共同作用。进一步采用实时荧光定量PCR及蛋白质免疫印迹技术检测体系中IDE、NEP的mRNA和蛋白表达水平。结果:20.00 μmol/L及以下浓度的BaP处理,20.00、40.00 mg/L的Aβ1-42寡聚体或Aβ1-42纤维体单独处理,BaP与Aβ1-42寡聚体或BaP与Aβ1-42纤维体联合处理对神经胶质细胞的存活率均无明显影响。与对照组相比,BaP单独处理组中IDE、NEP的mRNA和蛋白水平均未明显改变;而Aβ1-42寡聚体单独作用可明显上调IDE的mRNA及蛋白水平( P<0.05),同时BaP预处理可显著抑制Aβ1-42寡聚体作用引起的IDE表达水平上调( P<0.05);另一方面,Aβ1-42纤维体在单独处理或有BaP预处理情况下,IDE、NEP的mRNA和蛋白水平均未发生明显改变。结论:在对细胞存活率无明显影响的前提下,BaP预处理显著抑制了Aβ寡聚体作用后的IDE表达水平上调,提示苯并[a]芘可能干扰Aβ寡聚体降解途径导致Aβ增多聚集,进而可能促进认知功能降低及阿尔兹海默病的形成。
Objective:To investigate effects of benzo(a)pyrene (BaP) on expressions of insulin-degrading enzyme (IDE) and neprilysin (NEP) which have the ability to degrade β-amyloid (Aβ) in neu-roglia cells.Methods:Primary mix-neuroglia cells were cultured from newborn SD rats. After exposure to BaP, Aβ1-42 oligomer or Aβ1-42 fiber individually or jointly for 24 h, the cell survival rate was mea-sured by cell counting kit-8 (CCK-8). Afterwards, the primary mix-neuroglia cells were divided randomly into six groups: Control group, BaP group (2.00 μmol/L), Aβ1-42 oligomer group (20.00 mg/L), BaP plus Aβ1-42 oligomer group, Aβ1-42 fiber group (20.00 mg/L) and BaP plus Aβ1-42 fiber group, of which BaP was pretreated for 12 h followed by cotreatment with different aggregated Aβ1-42. The expressions of IDE and NEP were measured by quantitative real-time polymerase chain reaction (qRT-PCR) for mRNA level and Western blotting for protein level.Results:The cell survival rate showed no significant differences after treatment with BaP (≤20.00 μmol/L), Aβ1-42 oligomer (20.00, 40.00 mg/L), Aβ1-42 fiber (20.00, 40.00 mg/L) or cotreatment with BaP and Aβ1-42 oligomer or BaP and Aβ1-42 fiber. Compared with the control group, expressions of IDE and NEP in BaP-treated alone group had no obvious change; however, exposure to Aβ1-42 oligomer alone significantly increased the mRNA and protein level of IDE ( P<0.05), and the BaP pretreatment could significantly inhibit the up-regulated expressions of IDE by Aβ1-42 oligomer ( P<0.05); on the other hand, exposure either to Aβ1-42 fiber alone or under the BaP pretreatment did not change the mRNA and protein level of IDE and NEP obviously.Conclusion:On the premise of no significant change of cell survival rate, BaP pretreatment inhibited the up-regulated expressions of IDE in primary mixed neuroglia cells under cotreatment with Aβ oligomer, indicating that BaP may disturb degradation of Aβ oligomer and cause deposition of β-amyloid and further induce cognitive decline and acceleration of Alzheimer.
苯并[a]芘[benzo(a)pyrene, BaP]是目前已知的主要环境污染物之一, 可广泛来源于炭烤食物、吸烟、燃料汽车、烹调油烟等人为因素和火山喷发、森林火灾等自然因素[1]。苯并[a]芘的致癌、致畸作用一直备受关注, 其神经毒性作用也不容忽视。BaP具有高脂溶性, 可透过血脑屏障直接入脑, 流行病学调查发现其职业暴露可降低焦炉工人神经行为学功能和多种神经递质水平[2, 3], 动物实验表明其急性、亚慢性、慢性暴露可导致受试动物认知能力下降、空间学习与记忆能力受损等神经行为学改变[4, 5, 6], 然而目前导致该现象发生的潜在机制仍未阐明。
研究发现脑内β -淀粉体(β -amyloid, Aβ )沉积增多和认知功能下降显著相关[7, 8], 且由Aβ 聚集形成的淀粉样斑块是阿尔兹海默病(Alzheimer’ s disease, AD)的典型病理特征之一[9]。研究表明, Aβ 清除障碍打破了脑内的Aβ 平衡, 引发Aβ 异常聚集是脑内淀粉样斑块形成的机制之一, 而蛋白酶降解途径是Aβ 清除的主要途径之一[10], 因此, 以脑啡肽酶(neprilysin, NEP)、胰岛素降解酶(insulin-degrading enzyme, IDE)为代表的Aβ 降解蛋白酶成为人们研究的焦点。生理情况下, 以星形胶质细胞和小胶质细胞为主的神经胶质细胞是表达和分泌NEP、IDE等Aβ 降解酶的主要细胞类型之一[11]。本研究以原代神经胶质细胞混合培养为细胞模型, 研究BaP对神经胶质细胞表达Aβ 降解酶IDE、NEP的影响, 以期为深入揭示BaP的神经毒性作用机制提供科学依据。
1.1.1 主要仪器 冷冻真空干燥机ALPHA 1-2 LD Plus购自德国Marin Christ公司, 透射电子显微镜JEM-1400购自日本JEOL公司, 多功能酶标仪购自德国BMG LABTECH公司, 实时荧光定量PCR仪购自美国Bio-Rad公司。
1.1.2 主要试剂 苯并[a]芘、多聚赖氨酸购自美国Sigma公司; DMEM/F12培养基、胎牛血清(fetal bovine serum, FBS)购自美国Gibco公司; Trizol溶液购自美国Invitrogen公司; 人合成Aβ 1-42冻干粉购自上海强耀生物有限公司; HiScriptⅡ Q RT SuperMix、SYBR Green Master Mix购自南京诺唯赞生物; 细胞增殖-毒性检测试剂盒(cell counting kit-8, CCK-8)、RIPA裂解液、蛋白浓度测定试剂盒(bicinchoninic acid, BCA)购自上海碧云天生物技术公司; 苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)、蛋白酶抑制剂购自美国Amresco公司; 兔单克隆抗体IDE、单克隆抗体GAPDH购自英国Abcam公司; 大鼠单克隆抗体NEP购自美国R& D公司; β -actin抗体购自北京Solarbio公司; 抗大鼠、小鼠、兔二抗均来自美国CST公司。
参照已有文献
出生24 h内的SD大鼠(清洁级)购自北京大学医学部实验动物科学部[动物合格证号:SCXK(京)2016-0010], 本研究获得北京大学生物医学伦理委员会批准。消毒后断颈处死, 分离出全脑, 解剖显微镜下去除小脑和嗅球, 剥离脑膜和血管, 收集脑组织于预冷的无血清DMEM/F12培养液中。轻轻吹打组织并过细胞筛网后, 1 500 r/min离心 10 min, 弃上清, 加10 mL预热的含10%(体积分数)FBS的DMEM/F12培养液获得单细胞悬液, 接种于多聚赖氨酸包被的培养板中, 并培养于含5%(体积分数)CO2的37 ℃恒湿培养箱中。培养3 d后更换新鲜且预热的培养液, 培养7 d左右的原代神经胶质细胞体系可用于后续细胞实验。
选取接种于96孔板的培养7 d左右的原代神经胶质细胞体系, 接受终浓度为0(空白对照)、0.01、0.10、1.00、2.00、5.00、10.00、20.00 μ mol/L BaP, 或终浓度为20.00、40.00 mg/L Aβ 1-42寡聚体、Aβ 1-42纤维体的培养液, 或终浓度为2.00 μ mol/L BaP和20.00 mg/L Aβ 1-42寡聚体/纤维体的共处理培养液, 100.0 μ L/孔, 3复孔为一组。作用24 h后, 避光条件下每孔加入10.00 μ L CCK-8工作液, 37 ℃、5%(体积分数)CO2条件下避光孵育2.5 h, 在450 nm波长下测定每孔的光密度值(D), 计算细胞存活率(细胞存活率=实验组平均D值/对照组平均D值× 100%)。
选取生长良好的培养7 d左右的原代神经胶质细胞体系, 先接受终浓度为2.00 μ mol/L的BaP预处理, 等浓度的PBS作为溶剂对照, 预处理时间为12 h。预处理结束后, 对照组和预处理组分别再接受终浓度为20.00 mg/L的Aβ 1-42寡聚体、20.00 mg/L的Aβ 1-42纤维体处理, 同样等浓度的PBS作为溶剂对照, 后处理时间为6 h时用于检测基因的转录情况, 24 h时用于检测蛋白的表达情况。最终随机分组情况为:对照组、BaP(2.00 μ mol/L)组、Aβ 1-42寡聚体(20.00 mg/L)组、BaP+Aβ 1-42寡聚体组、Aβ 1-42纤维体(20.00 mg/L)组、BaP+Aβ 1-42纤维体组。
原代神经胶质细胞在先后接受BaP预处理12 h和Aβ 1-42寡聚体或Aβ 1-42纤维体后处理6 h后, 弃去上清液, 加入Trizol溶液进行总RNA的抽提; 按照试剂说明配制逆转录反应体系, 按照25 ℃ 10 min、50 ℃ 30 min、85 ℃ 5 min程序将总RNA逆转录为cDNA; 经逆转录后得到的cDNA再进行实时荧光定量PCR, 选用SYBR Green荧光染料, 按照说明配制反应体系, 循环条件为95 ℃ 5 min 1次, 95 ℃ 10 s、60 ℃ 30 s, 40个循环。IDE上游引物为CGTGCACATAGGGTCACTGT, 下游引物为GGTGTGTTCTCCGCTGGTAA; NEP上游引物为AGCCGAA-GAAGAAACAGCGA, 下游引物为AAGTCCGTACATGGCTCAGC; GAPDH上游引物为TCTCTTGTGACAAAGTGGACAT, 下游引物为CTCGCTCCTGGAAGATGGTG。用2-Δ Δ Ct法计算处理组中目标基因相对于对照组的变化倍数(fold change)。
原代神经胶质细胞在先后接受BaP预处理12 h和Aβ 1-42寡聚体或Aβ 1-42纤维体处理24 h后, 弃去上清液, 加入含有PMSF及蛋白酶抑制剂的RIPA裂解液, 细胞刮破碎并转移至EP管中, 低温离心取上清, BCA蛋白定量法调整蛋白上样量至40 μ g, 于4%(质量分数)浓缩胶和7.5%(质量分数)分离胶中进行十二烷基硫酸钠-聚丙烯酰铵凝胶电泳后, 转印至聚偏二氟乙烯膜(孔径0.45 μ m)。5%(质量分数)脱脂奶粉室温封闭1 h, 一抗(IDE 1 :1 000, NEP 1 :500, GAPDH 1 :2 000, β -actin 1 :3 000)4 ℃孵育过夜, 室温孵育对应的二抗(1 :2 000)1 h, ECL化学发光法进行显影成像, Image J(NIH, 美国)进行灰度分析。
采用SPSS 20.0软件进行统计学分析。实验独立重复3次以上, 数据以均数± 标准差表示。两组间均数比较采用Student t检验; 多组间均数比较采用单因素方差分析(One-way ANOVA), 进一步组间两两比较采用LSD法检验。P< 0.05表示差异有统计学意义。
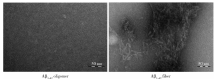
如图1所示, 透射电子显微镜下不同聚集状态的Aβ 1-42形态有明显的差别, 主要表现为Aβ 1-42寡聚体呈球形或椭圆球形颗粒, 均质分布, 较少聚集为大的团块状; 而Aβ 1-42纤维体在镜下呈现长条纤维状, 聚集相对紧密, 交联相对较少。
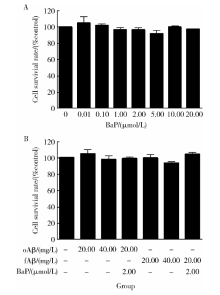
原代神经胶质细胞经BaP及Aβ 1-42各组处理24 h后的细胞存活率见图2。终浓度为0.01、0.10、1.00、2.00、5.00、10.00和20.00 μ mol/L的BaP处理组的细胞存活率均值分别为对照组的104.9%、102.0%、96.6%、96.7%、92.0%、100.1%和97.4%, 与对照组相比, 不同浓度的BaP处理组的细胞存活率变化差异无统计学意义(图2A)。终浓度为20.00、40.00 mg/L的Aβ 1-42寡聚体单独处理组及2.00 μ mol/L BaP和20.00 mg/L Aβ 1-42寡聚体联合处理组的细胞存活率均值分别为对照组的104.5%、97.7%和98.9%, 终浓度为20.00、40.00 mg/L的Aβ 1-42纤维体单独处理组及2.00 μ mol/L BaP和20.00 mg/L Aβ 1-42纤维体联合处理组的细胞存活率均值分别为对照组的99.5%、93.4%和104.2%, 各处理组的细胞存活率百分比相对于对照组差异均无统计学意义, 且各处理组间差异亦无统计学意义(图2B)。
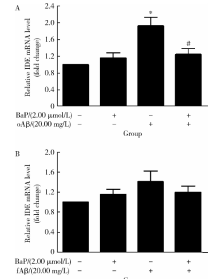
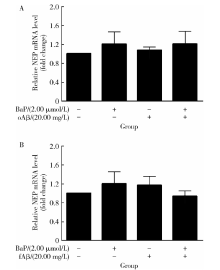
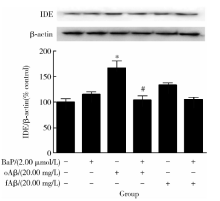
图3和图4结果表明, 仅有BaP预处理未能引起IDE、NEP的mRNA表达显著改变。图3A显示, Aβ 1-42寡聚体单独处理6 h, IDE的mRNA表达有明显增加, 变化倍数上调为(1.93± 0.44)倍, 与对照组相比差异有统计学意义(t=3.934, P< 0.05); 而在有BaP预处理12 h的前提下, Aβ 1-42寡聚体引起的IDE mRNA水平升高被显著抑制(t=2.503, P< 0.05)。图4A显示, Aβ 1-42寡聚体在单独处理或有BaP预处理的情况下, NEP mRNA水平均未出现有统计学意义的差异。从图3B和4B结果可见, 相对于Aβ 1-42纤维体单独处理, BaP预处理使得Aβ 1-42纤维体作用下的IDE、NEP mRNA水平虽有下降的趋势, 却未达到统计学显著水平(P> 0.05)。
图5显示, 与对照组相比, BaP或两种Aβ 1-42单独处理后, IDE蛋白水平均有上调的趋势, 但只有在Aβ 1-42寡聚体单独处理下差异有统计学意义(t=5.450, P< 0.05); 而该Aβ 1-42寡聚体引起的IDE蛋白水平升高, 在有BaP预处理12 h的前提下, 被显著抑制(t=5.136, P< 0.05)。另一方面, 与Aβ 1-42纤维体单独处理相比, BaP预处理虽有抑制IDE蛋白水平增高的趋势, 但未达到统计学显著水平。
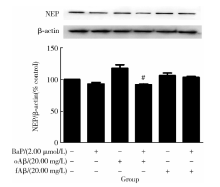
图6显示, 与对照组相比, BaP或Aβ 1-42纤维体单独处理后NEP蛋白水平未出现显著性改变, 相比之下, Aβ 1-42寡聚体单独处理虽有升高NEP蛋白水平的趋势, 但未达到统计学显著水平; 而与不同聚集状态的Aβ 1-42单独处理相比, BaP预处理虽未能改变Aβ 1-42纤维体作用下的NEP蛋白水平, 却显著降低了Aβ 1-42寡聚体作用下的NEP蛋白水平(t=6.073, P< 0.05)。
苯并[a]芘是一种环境中广泛存在的具有多种健康危害效应的多环芳烃类化合物[1]。脑内的细胞色素氧化酶P450含量相对较低, 因此, 进入脑内的BaP可直接与细胞溶质内的芳香烃受体(aryl hydrocarbon receptor, AHR)结合, 使AHR与其伴侣蛋白, 如热休克蛋白90分离, 并与芳香烃受体核转运蛋白(aryl hydrocarbon receptor nuclear translocator, ARNT)结合, 形成BaP-AHR-ARNT复合物, 随后与基因组上位于启动子区域的外源性物质应答元件(xenobiotic response element, XRE)相互作用, 进而干扰多种脑内蛋白的表达[13]。本研究以大鼠原代神经胶质细胞混合培养为研究对象, 通过分析不同聚集状态的Aβ 1-42诱导后IDE、NEP的mRNA、蛋白表达水平, 探讨BaP预处理是否影响神经胶质细胞中IDE、NEP等Aβ 蛋白降解酶的表达。
IDE是相对分子质量为11× 104的锌内肽酶, 也是最早发现的Aβ 降解酶, 可水解包括胰岛素、β 淀粉体在内的多种蛋白多肽[14]。多项研究表明, 胞质内或膜结合的IDE均能影响脑内Aβ 水平, 其中IDE基因敲除的小鼠动物模型相对于野生基因型小鼠, 脑内有较高的Aβ 沉积物水平[15]。另一方面, 过表达的IDE可降低转基因鼠脑内Aβ 水平, 减缓淀粉样斑块的形成, 提高认知功能[16]。此外, 流行病学研究发现, 在AD高危人群脑中的海马区, IDE蛋白酶水平是降低的, 相应有Aβ 水平的增高[17], 表明IDE酶在Aβ 清除中发挥关键作用。同样, NEP也是锌依赖的金属内肽酶, 它属于跨膜肽酶且带有较长的细胞外区域, 该区域构成了其主要的水解功能域, 除胶质细胞外, NEP还多见于神经元突触前端, 尤其是海马区和皮质区的神经元内[18]。多项动物试验已经验证了NEP对于脑内Aβ 平衡所起的作用, 与野生型对照鼠相比, NEP基因敲除的模型鼠脑内Aβ 沉积水平明显升高, 且其神经行为学功能显著下降[19], 对比之下, NEP表达上调的模型鼠脑内Aβ 水平降低[13]。另有荟萃分析研究发现, 相对于非AD且认知功能正常的对照组, AD患者脑内NEP表达水平显著下降[20]。由此可知, IDE、NEP蛋白酶确实在维持脑内Aβ 水平平衡中发挥着重要作用, 其水平的下降可能导致机体Aβ 异常聚集, 进而影响正常脑功能, 出现认知、记忆功能下降等神经行为学异常。
本研究结果显示, 剂量达到20.00 μ mol/L的BaP对原代神经胶质细胞没有明显毒性作用(图2), 相关研究也表明, 类似剂量的BaP作用于原代神经元细胞、永生化神经元细胞以及永生化小胶质细胞均未出现细胞活力的明显变化[21]。同时, Aβ 1-42寡聚体和Aβ 1-42纤维体是Aβ 异常聚集过程的两种形态, 本研究中无论是Aβ 1-42寡聚体或Aβ 1-42纤维体本身, 还是分别与BaP共同作用, 对神经胶质细胞均没有显著毒性, 这些结果提示BaP对整体神经系统的直接毒性均不显著。另外, 本研究结果显示, 神经胶质细胞中IDE与NEP的表达能够不同程度地被Aβ 1-42寡聚体或Aβ 1-42纤维体调控。其中, Aβ 1-42寡聚体处理后引起IDE的mRNA与蛋白水平显著上调, 对NEP表达的调控则不显著; 相对而言, Aβ 1-42纤维体则对IDE与NEP均没有显著的表达调控作用。可见Aβ 1-42寡聚体与Aβ 1-42纤维体不仅形态有明显差异, 且生物学效应也不尽相同, 有研究表明, Aβ 寡聚体相对于纤维体对细胞有更强的毒性效应[22], 本实验中不同聚集状态的Aβ 作用下的结果与该假设一致。除此之外, Aβ 寡聚体和纤维体在降解途径上也有各自的特点。
目前发现, 脑内有Aβ 降解作用的蛋白酶除IDE、NEP外, 还有内皮素转换酶、基质金属蛋白酶9等, 但这些蛋白酶对不同聚集状态Aβ 的降解能力不同, 因此, 我们首先要区别仅能降解Aβ 单体及寡聚体的蛋白酶和Aβ 寡聚体、纤维体均能降解的蛋白酶, 而后者的种类目前发现较少, 可能与Aβ 纤维体在聚集成淀粉样纤维时, 结构发生改变, 对一系列蛋白酶产生了抗水解能力有关, 本实验中的研究对象IDE、NEP是属于主要降解Aβ 单体及寡聚体的典型代表[23]。此外, 神经元或神经胶质细胞对β 淀粉体的吞噬作用也是脑内清除Aβ 的重要途径。在吞噬机制方面, Aβ 寡聚体和纤维体可通过多种受体介导而被内化吞噬, 如清道夫受体、Toll样受体、高级糖基化终末产物受体等, 在不同受体介导下, Aβ 寡聚体和纤维体可被内化到不同的细胞内[24]。广泛被认可的是, 小胶质细胞主要识别并吞噬Aβ 纤维体, 尤其在补体系统C3b受体的介导下更突出[25]; 而星形胶质细胞在肌动蛋白的调节下主要识别和吞噬Aβ 单体及寡聚体[26]。蛋白酶降解Aβ 类型的不同及进入胶质细胞类型的差异, 可能是本研究中仅Aβ 1-42寡聚体起作用, 而Aβ 1-42纤维体对IDE与NEP没有显著的表达调控作用现象的一个原因。另有研究表明, NEP主要在激活的小胶质细胞和星形胶质细胞中高表达[11], 本研究中神经胶质细胞未有明显激活, 可能是Aβ 1-42寡聚体仅引起IDE表达水平上调, 对NEP表达的调控不显著的原因之一。
BaP作为一种环境污染物, 其单独作用并没有引起神经胶质细胞中IDE和NEP表达显著改变, 提示BaP的下游通路可能不直接影响IDE与NEP的表达。而在Aβ 1-42寡聚体作用于胶质细胞后, BaP的预处理能显著抑制胶质细胞中IDE的mRNA与蛋白水平升高, 提示BaP预处理可能对Aβ 1-42寡聚体的降解途径有干扰作用。另一方面, NEP的表达在Aβ 1-42寡聚体作用下变化不显著, 而BaP的预处理也对NEP的表达没有显著影响, 提示BaP可能是通过抑制Aβ 1-42寡聚体的下游通路从而抑制了IDE表达, 其分子机制需要进一步的实验验证。此外, Aβ 1-42纤维体对神经胶质细胞中IDE与NEP的表达影响均不显著, 而BaP也没有显著影响IDE与NEP的表达, 进一步表明BaP并未直接作用于IDE与NEP的基因表达。
综上所述, 本研究观察到, 在对细胞存活率无明显影响的前提下, BaP预处理可显著抑制Aβ 寡聚体作用后的IDE表达水平上调, 提示BaP可能干扰Aβ 寡聚体降解途径导致β 淀粉体增多聚集, 这可能是BaP暴露促进认知功能降低及AD形成的潜在机制之一。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|