目的:引进在成釉细胞中表达RhoA显性抑制基因的EGFP-RhoADominant Negative (EGFP-RhoADN)转基因鼠模型,研究RhoA通路对成釉细胞黏附连接复合体的影响,探索EGFP-RhoADN转基因鼠牙釉质发育缺陷的机制,为牙胚发育及牙齿再生的研究提供实验依据。方法:所有实验均以EGFP-RhoADN转基因鼠为实验组,以同时期野生型小鼠为对照组。使用扫描电子显微镜观察1月龄的两组小鼠下颌第一磨牙牙釉质外形,每组样本量为20,记录牙釉质厚度。采用RT-PCR、Western blot方法检测并比较出生后4 d(postnatal-4-day,P4)的两组小鼠下颌第一磨牙上皮层细胞间黏附连接复合体成分基因和蛋白表达的改变。结果:1月龄的EGFP-RhoADN转基因鼠下颌第一磨牙牙釉质厚度比同时期野生型小鼠牙釉质厚度下降[(84.60±0.20) μm vs.(106.24±0.24) μm, P<0.05],出生后4 d的EGFP-RhoADN转基因鼠成釉细胞层上皮钙黏附蛋白(epithelium-cadherin,E-cadherin)、α-上皮连环蛋白(α-E-catenin)、pan-钙黏附蛋白(pan-cadherin)表达水平较同时期野生型小鼠下调,β-连环蛋白(β-catenin)表达水平较同时期野生型小鼠上调,E-cadherin基因表达量较同时期野生型小鼠下调(0.93±0.01 vs. 1.00±0.02, P<0.05),β-catenin基因表达量较同时期野生型小鼠上调(1.23±0.03 vs. 1.00±0.05, P<0.05)。结论:EGFP-RhoADN转基因鼠的下颌第一磨牙牙釉质发育出现缺陷,牙釉质厚度下降,这一现象可能是由于RhoA通路抑制引起成釉细胞黏附连接的改变,从而影响了牙釉质正常发育。
Objective:To investigate the regulation mechanism of RhoA signaling pathway during the enamel formation by using the EGFP-RhoADominant Negative (EGFP-RhoADN)transgenic mice model, from the aspect of adherens junctions, and to provide a theory basis for mechanism of enamel development defects.Methods:The enamel thickness of mandibular first molars of EGFP-RhoADN transgenic mice and wild type (WT) mice were observed by scanning electronic microscopy at 20 kV, and the enamel thickness of the distal face of the central cusp was measured at 10 locations via analysis by ImageJ (Rasband, 1997-2009). The enamel organs from mandibular first molars from postnatal-4-day (P4) EGFP-RhoADNmice and wild type mice were isolated, and the total RNA and protein were extracted from the epithelium of the enamel organs. The expression level of the adherens junctions components in ameloblasts layer of the postnatal-4-day EGFP-RhoADN transgenic mice and wild type mice mandibular first molars were detected by real-time PCR and Western blot assay.Results:The EGFP-RhoADN transgenic mice had decreased enamel thickness in their bilateral mandibular first molars versus those of control group ( n=20), and enamel thickness was (84.60±0.20) μm vs. (106.24±0.24) μm, P<0.05 .The protein expressions of E-cadherin, α-E-catenin and pan-cadherin in ameloblasts layer of postnatal-4-day EGFP-RhoADN transgenic mice molars were down-regulated, and the protein level of β-catenin in ameloblasts layer of P4 EGFP-RhoADN transgenic mice molars was up-regulated. The mRNA level of E-cadherin in ameloblasts layer of P4 EGFP-RhoADN transgenic mice molars was down-regulated versus that of WT mice, and the gene expression of E-cadherin was 0.93±0.01 vs. 1.00±0.02, P<0.05. The mRNA level of β-catenin in ameloblasts layer of P4 EGFP-RhoADN transgenic mice molars was up-regulated versus that of WT mice, and the gene expression of β-catenin was 1.23±0.03 vs. 1.00±0.05, P<0.05.Conclusion:In the mandibular first molars of EGFP-RhoADN transgenic mice, the enamel formation was disrupted and the adherens junctions of EGFP-RhoADN transgenic mice ameloblasts were implicated during amelogenesis. RhoA signaling pathway may play a critical role in enamel development by altering the adherens junctions in ameloblasts.
在牙釉质发育过程中, 成釉细胞经历了多个阶段的形态变化, 在分泌期, 成釉器的内釉上皮细胞分化成为高柱状成釉细胞, 开始从富含肌动蛋白的结构— — 托姆斯突(Tomes processes)一端分泌釉原蛋白、釉蛋白及成釉蛋白, 辅助矿物晶体的延长, 当牙釉质层达到最终厚度时, 成釉细胞变短, 过渡成为成熟期成釉细胞, 使晶体增宽增厚从而将釉质层变硬[1, 2, 3]。成釉细胞形态及功能变化与细胞骨架结构有关, G蛋白(全称为鸟苷酸结合蛋白, 有GTP酶活性)是一类位于膜内侧的偶联蛋白, 在信号转导中有关键作用。小分子G蛋白家族中的大鼠肉瘤病毒同源癌基因A (ras homology oncogen A, RhoA)蛋白作为分子开关调节着细胞骨架的动态变化, 并参与控制细胞多种生理活动, 包括细胞黏附、伸展、皱缩、迁移, 细胞分裂、增殖、分化等[4, 5]。RhoA效应分子Rho相关卷曲螺旋形成蛋白激酶 (Rho associated coiled coil forming protein kinase, ROCK), 在调节RhoA诱发的应力纤维和黏附斑形成过程中有重要作用[6]。
黏附连接(adherens junction, AJ)是位于相邻细胞间的连接复合体, 包括上皮钙粘蛋白(epithelium-cadherin, E-cadherin)、 p120连环蛋白(p120-catenin)、 β -连环蛋白(β -catenin)和ROCK[7]。β -catenin又可以作为桥梁使α 连环蛋白(α -catenin)结合于E-cadherin胞内段, α -catenin直接与肌动蛋白肌丝相互作用。这一由E-cadherin调节的黏附结构形成了能够调节细胞骨架重组、细胞极性和小泡转运的胞间信号[8]。E-cadherin的汇聚能激活一些小G蛋白(包括RhoA、Rac 和Cdc42)[9], 调节细胞骨架动态变化, 同时, 在E-cadherin调控的黏附结构对上皮生发的影响中, 活化的小G蛋白也有重要的调节作用[8], RhoA的活性对于钙黏蛋白在胞间接触区的聚集是必需的[10, 11]。由于在鼠磨牙成釉器的蕾状期、帽状期和钟状早期的上皮层都有E-cadherin表达, 说明E-cadherin对于保持成釉器的形态有重要作用。Otsu等[12]报道RhoA/ROCK信号能够影响黏附连接复合体的特异性分布, 进而影响成釉细胞的分化。
美国宾夕法尼亚大学Gibson实验室通过牙胚的体外培养[13], 证实RhoA作为一种关键的分子信号开关, 能够在NaF作用下激活RhoA/ROCK通路, 从而上调成釉细胞中肌动蛋白纤维(fibrous-actin, F-actin)的表达, 因此提出过量的氟通过激活成釉细胞的RhoA通路造成F-actin表达上调, 进而导致细胞骨架、相关基因转录及蛋白表达的改变, 影响成釉细胞与托姆斯突的结合, 造成釉质发育障碍的假设, 为验证这一假设, Gibson实验室建立了EGFP-RhoA显性抑制(EGFP-RhoADominant Negative, EGFP-RhoADN)转基因鼠模型, 并且发现1月龄的EGFP-RhoADN转基因鼠牙釉质发育受到了明显的影响, 表型类似于釉质发育不全, 目前正在进一步研究EGFP-RhoADN转基因鼠牙釉质发育的信号传导机制, 期待揭示EGFP-RhoADN转基因鼠釉质发育障碍的原因。
基于这些认识, 本课题组利用EGFP-RhoADN转基因鼠牙胚钟状早期至分泌末期RhoA通路受到阻滞这一特点, 针对EGFP-RhoADN转基因鼠磨牙上皮黏附连接的变化进行实验, 探究上皮RhoA信号通路对于牙胚上皮细胞黏附连接及釉质发育的影响。
课题组引进并成功饲养美国宾夕法尼亚大学Gibson博士实验室馈赠的EGFP-RhoADN转基因鼠, 购买并成功饲养野生型(C57B6)小鼠。选择SPF级动物饲养中心作为培养地点, 保证EGFP-RhoADN转基因鼠及野生型(wild type, WT)小鼠的存活及有序繁殖。实验分组: (1)对照组(野生型组):健康的1月龄野生型(C57B6)小鼠30只; (2)实验组(转基因鼠组):健康的1月龄EGFP-RhoADN 转基因小鼠30只。
参考Gibson实验室对该转基因鼠模型进行基因鉴定时用到的PCR引物:G929 TAA GTC CTG TCA GTC AGA ACA CCT, G1108 TGA ACA GCT CCT CGC CCT TGC TC[13], 由上海英骏公司合成引物。提取EGFP-RhoADN转基因鼠及野生型小鼠尾部组织DNA, 进行PCR扩增, 鉴定基因。
选择出生后1月龄健康的EGFP-RhoADN转基因小鼠及野生型小鼠各10只, 处死, 剪取下颌骨, 4%(体积分数)多聚甲醛中固定过夜。于超声波清洗机中清洁下颌磨牙表面10 min, 去离子水冲洗后晾干下颌磨牙样本。将样本固定于基座上, 表面喷镀金属, 置于Inspect F50场发射扫描电子显微镜下观察磨牙形态, 电压为20 kV 。在测量釉质厚度时, 以下颌第一磨牙颊侧中央牙尖处的釉质厚度为检测对象, 近远中向打磨磨牙, 暴露牙尖近远中向断面。根据扫描电子显微镜观测的图像, 运用ImageJ软件(Rasband, 1997— 2009)分析、测量EGFP-RhoADN转基因小鼠组和野生型小鼠组各20个样本的牙尖釉质厚度。
收集出生后4 d(postnatal-4-day, P4)的野生型及EGFP-RhoADN转基因鼠双侧下颌第一磨牙牙胚各10个, 体视显微镜下使用显微外科手术器械机械分离牙胚上皮和间充质组织, 收集上皮组织, 按QIAGEN Rneasy Mini kit RNA提取试剂盒说明书提取总RNA逆转录合成cDNA(Takara公司), 配制20 μ L体系反应液, 采用Primer 5.0引物设计软件设计RT-PCR引物(表1), 由上海英骏公司合成引物。配制25 μ L反应体系, 设置反应条件, 进行PCR反应。
| 表1 目的基因的引物序列 Table 1 Sequence of primers of target genes |
收集出生后4 d野生型及EGFP-RhoADN转基因鼠下颌第一磨牙牙胚各约30个, 体视显微镜下显微外科手术器械机械分离牙胚上皮和间充质组织, 收集上皮组织, 使用RIPA裂解法提取总蛋白。BCA法测定蛋白浓度, 以蛋白浓度最小的样品为基值, 以30 μ g蛋白量计算上样量。然后进行聚丙烯酰胺凝胶电泳、转膜、滤膜杂交、显色, 置于BIO-RAD化学发生成像系统中成像, 并用配套Quantity One软件分析。
抗体有兔抗鼠E-cadherin单克隆抗体, 兔抗鼠pan-cadherin单克隆抗体, 兔抗鼠β -catenin单克隆抗体, 兔抗鼠α -E-catenin单克隆抗体(Cell Signaling Technology, 美国), 兔抗鼠GAPDH单克隆抗体(Santa Cruz Biotechnology, 美国)。
采用SPSS16.0软件对定量结果进行统计学分析, 定量数据均采用均数± 标准差表示。两组数据之间的比较采用独立样本t检验, P< 0.05认为差异有统计学意义。
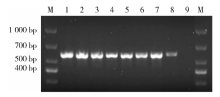
转入基因的PCR产物为500~700 bp(图1), #1~#8为EGFP-RhoADN转基因鼠组, #9为野生型小鼠; 其中#1~#7的转基因表达较明显, 选为后续实验的实验组。每次进行后续实验之前, 均按照基因鉴定的结果, 选择转入基因表达较明显的小鼠, 作为后续实验的实验组。
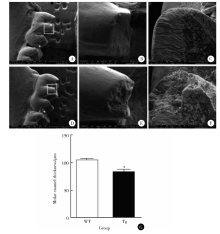
1月龄EGFP-RhoADN转基因鼠下颌第一磨牙牙尖部位出现牙釉质缺陷, 类似于牙釉质发育不全(图2D~F)。1月龄EGFP-RhoADN转基因鼠下颌第一磨牙牙釉质厚度低于同时期野生型小鼠[样本量为20, 牙釉质厚度为(84.60± 0.20) μ m vs. (106.24± 0.24) μ m, P< 0.05, 图2G]。
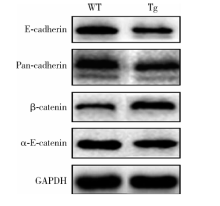
Western blot检测结果显示, 与同时期野生型小鼠相比, 出生后4 d的EGFP-RhoADN转基因鼠下颌第一磨牙牙胚成釉细胞上皮中E-cadherin, pan-cadherin, α -E-catenin蛋白表达水平出现下调, β -catenin蛋白表达水平出现上调(图3, 样本量为30)。
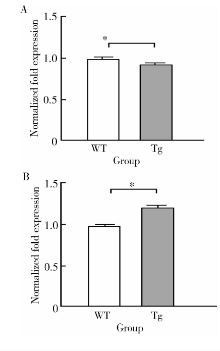
在出生后4 d的EGFP-RhoADN转基因鼠双侧下颌第一磨牙牙胚成釉细胞上皮中, E-cadherin基因的mRNA水平较同时期野生型小鼠显著下降(样本量为10, 基因表达量为0.93± 0.01 vs. 1.00± 0.02, P< 0.05, 图4), β -catenin基因的mRNA水平较同时期野生型小鼠显著上调(样本量为10, 基因表达量为1.23± 0.03 vs.1.00± 0.05, P< 0.05, 图4)。
Gibson实验室学者将RhoADN(RhoA显性抑制, RhoADominant Negative)基因片段与EGFP标记蛋白在体外连接, 再插入一段小鼠釉原蛋白(amelogenin, AmelX)调节序列, 注射进入小鼠囊胚。由于在牙胚上皮帽状后期AmelX表达上调, 能够对牙胚上皮组织内的RhoA通路进行抑制, 建立EGFP-RhoADN转基因鼠模型, 并且发现1月龄的EGFP-RhoADN转基因小鼠牙釉质发育受到了明显的影响, 表型类似于釉质发育不全[14]。
AmelX在成釉细胞增殖分化期表达为阴性, 在分泌初期的成釉细胞内及新生釉基质中开始出现阳性表达, 在分泌期的成釉细胞内及新生釉基质中均呈强阳性表达。一旦分泌完成或釉质已形成, 釉原蛋白就降解消失, 成熟釉质中没有釉原蛋白表达。而RhoA蛋白是一类位于细胞膜内侧的偶联蛋白, 作为分子开关调节着细胞骨架的动态变化, 成釉细胞中RhoA及其效应分子ROCK通过调节釉原蛋白的表达, 对细胞的直接分化有重要作用[15]。Otsu等[12]针对小鼠切牙进行活性 (GTP-bound) RhoA和总RhoA免疫组化染色的研究显示, 在成釉细胞分化进程中, 活性RhoA主要在分泌期成釉细胞的近中端和基底端表达, 但是在星网状层、内釉上皮层或前成釉细胞中未见表达; 总RhoA在内釉上皮层和前成釉细胞的细胞质中呈均匀分布表达, 但在星网状层细胞质中未见表达, 而是集中于分泌期成釉细胞的近中端和基底端表达。这些发现提示RhoA活性对成釉细胞分化有重要作用。
另外, Otsu等[12]在体外采用功能获得和功能丧失的方法证明轴突导向因子4D (semaphorin 4D, Sema4D)可以作为RhoA上游调控成釉细胞的极性和釉原蛋白的表达。牙胚上皮以自分泌或旁分泌形式分泌Sema4D, 与丛状蛋白B1(plexin-B1)相连接, 募集Rho鸟苷酸交换因子(guaninenucleotide exchanging factors, GEFs)至细胞皮质。RhoGEF促进RhoA-GDP转换为RhoA-GTP, 进而激活下游效应因子ROCK。ROCK通过蛋白激酶B促进釉原蛋白定向分泌以及抑制细胞增殖, 并且改善连接复合体的特异性分布, 进而促进成釉细胞分化。本研究采用的EGFP-RhoADN转基因鼠模型的特点是在牙胚发育的钟状早期至分泌期末这段时间内, 成釉细胞层RhoA通路呈抑制状态。所以本研究EGFP-RhoADN转基因小鼠下颌第一磨牙出现釉质发育不全的可能机制是抑制状态的RhoA通路对釉原蛋白定向分泌、连接复合体特异性分布、细胞增殖状态等产生影响, 进而干扰成釉细胞的正常分化及釉质基质的形成。EGFP-RhoADN转基因鼠模型为研究RhoA信号通路在体内对正常釉质发育的影响提供了实验基础。
E-cadherin/catenin复合体与细胞骨架成分、调节元件、信号分子相连接, 形成了成熟的黏附连接(adherens junction, AJ), 这一结构对于组织稳态和重组中上皮完整性的维持和胞间连接的调节是必需的。很多分子参与调节黏附连接的形成和完整性, 包括Rho家族GTP酶及Par极性蛋白[16]。RhoA也能通过Diaphanous1(Dia1)、非肌肉肌球蛋白Ⅱ 和肌动肌球蛋白的收缩作用协助维持E-cadherin黏附连接[17, 18, 19]。在其他模型中, 用多种方法使内源性RhoA降低, 会导致E-cadherin连接结构的弱化[8, 20], 这一报道利于解释本实验中发现的EGFP-RhoADN转基因鼠成釉器中E-cadherin, pan-cadherin 和α -E-catenin蛋白水平的降低, 及E-cadherin mRNA 水平的下降。另外, 本研究Western blot实验样品为出生后4 d的两组小鼠成釉细胞细胞膜与胞浆的总蛋白, 实验结果中EGFP-RhoADN转基因鼠β -catenin 蛋白表达上调, 反映的是细胞膜中β -catenin和胞浆中β -catenin的总体表达水平, 而黏附连接复合体中β -catenin具体出现怎样的变化尚需进一步实验探究。
在胚胎发育期间, E-cadherin可能参与了成釉细胞的极性形成[21]。在切牙成釉细胞的分化过程中, 钙黏蛋白的水平出现周期性的下降和上升, 很可能对形成有序的细胞重组有促进作用[22]。胞间接触区E-cadherin/catenin复合体的弱化会引起成釉细胞极性、分化及重组的改变, 从而能够解释之前研究中观察到的EGFP-RhoADN转基因鼠磨牙釉质发育缺陷。
基于EGFP-RhoADN转基因鼠模型在牙胚发育的钟状早期至分泌期末这段时间内, 牙胚上皮RhoA通路出现阻滞的这一模型特点, 本研究结果表明, 在RhoA通路被抑制的情况下, EGFP-RhoADN转基因鼠磨牙上皮黏附连接出现变化, 可能是引起EGFP-RhoADN转基因鼠磨牙牙胚发育障碍、出现釉质发育不全的原因。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|