目的:使用自组装非对称流场流分离(asymmetrical flow field-flow fractionation, AF4)仪器对脂蛋白的分离条件进行优化,分析仪器的分离性能并验证载液黏度对分离效果的影响。方法:使用2种标准蛋白(碳酸酐酶和甲状腺球蛋白)初步验证自组装非对称流场流分离仪器的性能,标定分离通道相关参数(压制后的分离通道实际高度), 进而通过四水平五因素的正交设计试验进行脂蛋白的分离条件优化,通过直观分析和方差分析评价差异具有统计学意义的影响因素,并对这些影响因素进行深入验证分析。结果:通过调节流速条件及载液条件得到碳酸酐酶和甲状腺球蛋白混合样品的分离图,根据流体动力学原理及Stoke’s公式计算得到分离通道高度为164 μm。使用正交设计试验得到优化后的分离条件可实现高密度脂蛋白与低密度脂蛋白大于1.50的分离度(分离度为1.61和1.58),所选取的5种主要影响因素及其水平分别为分离总流速(3.00, 3.50, 4.00, 4.50 mL/min)、聚焦时间(3.00, 3.50, 4.00, 4.50 min)、过渡时间(0.5, 1.0, 1.5, 2.0 min)、载液pH(6.8, 7.00, 7.20, 7.40)、载液黏度(使用不同浓度的羟丙基甲基纤维素调节载液黏度,其浓度分别为0.00%, 0.03%, 0.06%, 1.00%), 正交设计试验结果显示,5种主要因素中载液黏度对分离度影响最大,结果差异具有统计学意义。进一步分析载液黏度的影响,发现增大黏度可有效提高分离度,但会带来增大负峰的作用。结论:自组装非对称流场流分离仪器可根据颗粒的粒径差异对脂蛋白进行有效分离,在优化的条件下可实现高、低密度脂蛋白的基线分离,载液黏度对分离度的影响差异具有统计学意义。
Objective:To analyze and characterize the separation effectiveness of self-constructed asymmetrical flow field-flow fractionation system on proteins and lipoproteins, to achieve the optimization of the experimental conditions when separating lipoproteins by orthogonal design test and to investigate the carrier viscosity’s influence on separation effectiveness.Methods:The evaluation of asymmetrical flow field-flow fractionation separation capacity was conducted by using two standard proteins (carbonic anhydrase and thyroglobulin). Under the optimized separation conditions of carbonic anhydrase and thyroglo-bulin, the channel actual thickness (after assembling, the actual thickness of separation channel was less than initial thickness) was calculated by the analytes’ elution time based on the hydrokinetic theory. With orthogonal design test the optimized experimental conditions were studied and statistical analysis was carried on to find out the factors with statistical significance which needed further exploration.Results:According to the hydrodynamics principle and Stoke’s function, the channel actual thickness was mea-sured to be 164 μm by separating the two standard proteins, carbonic anhydrase and thyroglobulin, under proper experimental conditions. By the optimization based on orthogonal design test, base-line separation (the resolution had to be higher than 1.50) was achieved. The resolutions of the two experiments were 1.61 and 1.58.According to previous study/ pre-study and supporting theory, in the orthogonal design test, the total 5 factors were integrated for comprehensive investigation: the total flow rate (3.00, 3.50, 4.00, 4.50 mL/min), focus time (3.00, 3.50, 4.00, 4.50 min), transition time (0.5, 1.0, 1.5, 2.0 min), pH of the carrier fluid(6.8, 7.00, 7.20, 7.40) and viscosity of the carrier fluid hydroxypropylmethylcellulose concentration: 0.00%, 0.03%, 0.06%, 1.00%). Among the 5 factors, viscosity was found to have the statistical significance on separation effectiveness which was further investigated. The resolution of high density lipoprotein and low density lipoprotein was increased by the increasing viscosity which also caused more obvious negative spikes.Conclusion:The separating capacities of self-constructed asymmetrical flow field-flow fractionation system on lipoproteins were verified to be effective and an optimized experimental condition was found to achieve the base-line separation of high density li-poprotein and low density lipoprotein. Viscosity of the carrier fluid was proved to have the statistical significance on lipoprotein separation.
场流分离是一项基于分析物的流体动力学粒径差异对分析物进行无损分离的技术, 分析物在载液的层流作用下, 根据粒径的差异分布在液流剖面不同高度的位置上, 较大的颗粒扩散到越靠近积累壁的位置从而晚于较小颗粒被洗脱。本研究所采用的非对称流场流分离(asymmetrical flow field-flow fractionation, AF4)系统是流场流分离系统的一个重要分支, 由Wahlund和Giddings在1987年提出[1], AF4通道上层壁为非渗透性的透明玻璃板, 可以直观反映有色样品在通道中的分离行为, 通道下层为可渗透性多孔材料, 构造见图1。由于分离范围广(从1 nm到50 μ m)[2], 无固定相填料, 对生物样品无机械力损害, 分离环境温和, 样品无需离心、过滤等前处理等优点, AF4在复杂生物样品分析领域广受欢迎[3]。Chen等[4]应用AF4联用多角度光散射检测器比较两种不同来源的病毒样颗粒(乙肝表面抗原)在不同溶液环境中的稳定性。Krystek等[5]在水蚤中贵金属纳米粒子成分和粒度分析时, 使用AF4联用ICP-MS测定水蚤急性短期暴露期间贵金属[金(Au)、铂(Pt)、银(Ag)]粒子粒径及颗粒分布信息。Bria等[6]使用AF4考察热应激抗蛋白链菌素(anti-SA)抗体的纳米级聚集体(< 0.1 μ m)和亚微米级聚集体(0.1~1 μ m), 并探究抗体蛋白的亚微米级凝聚动力学。
 | 图1 非对称流场流分离原理图(A)及自组装非对称流场流分离系统实际通道图(B)Figure 1 Schemes of asymmetrical flow field-flow fractionation mechanism(A) and real channel design of self-constructed flow field-flow fractionation system (B) |
脂蛋白是血液中负责运输脂质和胆固醇的球形复合物, 由甘油三酯和胆固醇酯组成内核, 外包裹由磷脂、游离胆固醇、蛋白质等组成的外壳, 根据脂蛋白的密度差异可将其分为高密度脂蛋白(high-density lipoprotein, HDL), 低密度脂蛋白(low-density lipoprotein, LDL)和极低密度脂蛋白(very low-density lipoprotein, VLDL)[7]。人体中脂蛋白功能与细胞结构、细胞内信号转导、细胞增殖和凋亡有着密切联系, 脂蛋白的浓度、粒径改变和性状分布与冠状动脉疾病发病风险密切相关, 其脂质代谢的变化通常会触发一些代谢性疾病, 因此在临床诊断及预后领域, 脂蛋白表征和脂质分析成为近年来的研究热点。
临床实践中测定脂蛋白的标准方法通常是测定血清或血浆脂蛋白胆固醇的含量[8], 而进行脂蛋白脂质分析时, 往往需要分离脂蛋白亚类。目前常用的分离方法包括密度梯度超速离心[9]和聚丙烯酰胺凝胶电泳[10], 根据脂蛋白的密度和粒径差异进行分离, 但是这两种方法不仅耗时, 而且密度梯度超速离心所需样品量大, 聚丙烯酰胺凝胶电泳需要从分离后的凝胶中回收脂蛋白颗粒; 尺寸排阻色谱法如高效液相色谱[11]可以快速测定脂蛋白胆固醇含量, 但是样品颗粒与固定相之间的相互作用难以避免; 毛细管等速电泳[12]在一些临床实验室中作为HDL的常规分离手段, 但是毛细管等速电泳在实际应用中成本较高, 影响样品性状且难以定量。非对称流场流分离系统可在生物友好的环境中分离生物样品, Qureshi等[13]改变AF4通道尺寸和载液条件优化LDL和VLDL的分离, 分离血浆中不同类型脂蛋白并采用在线酶法测定胆固醇和甘油三酯含量。
由于市面上的流场流分离仪器价格昂贵, 因此国外众多研究机构均采用自组装非对称流场流分离仪器进行替代研究。本研究中使用本课题组自组装非对称流场流分离仪器, 首先使用标准蛋白对仪器的分离性能进行初步表征, 并根据流体动力学理论对通道参数进行标定。使用正交设计试验对脂蛋白标准混合物的分离条件进行科学系统的优化, 综合评价自组装非对称流场流分离仪器在脂蛋白分离领域的可行效能。
1.1.1 仪器 本研究所使用的流场流分离仪器为自组装流场流分离仪器。单塞泵(L600-DP)、双塞泵(L610-P)、紫外检测器(L600-UV)、进样阀(7725i)购自中国北京普析通用有限公司; HANGPING天平(FA2104)购自中国上海天平仪器厂; LCWin-2.0 工作站由中国北京普析通用有限公司提供; 进样针(100 μ L)购自瑞士Hamilton公司; 聚碳酸酯膜(孔径1.0 μ m)购自英国AISIMO有限公司; 标准型精密pH计(UB-7)购自美国DENVER公司; 乌氏黏度计由北京大学医学部玻璃房自制。
1.1.2 试剂与样品 高密度脂蛋白(胆固醇水平> 200 mg/L, < 1% LDL)和低密度脂蛋白(胆固醇水平> 200 mg/L, < 1% HDL)来自人血浆, 购自以色列Prospecbio公司; 碳酸酐酶 (干重≥ 3 000 U/mg)来自牛红细胞, 购自美国Aladdin公司; 甲状腺球蛋白(纯度≥ 95%)来自牛甲状腺, 购自中国北京博奥森生物技术有限公司; 十二水合磷酸氢二钠(分析纯)和磷酸二氢钠(分析纯)购自北京化工厂; 羟丙基甲基纤维素购自美国Aladdin公司; 实验用水为超纯水(18.2 MΩ · cm)。
磷酸缓冲液:本研究中所使用的载液及用于混合样品的溶液均为0.1 mol/L的磷酸缓冲液, 具体配制方法为精密称定约58 g Na2HPO4· 12H2O和6 g NaH2PO4· 2H2O, 分别用超纯水溶解后混合并用超纯水定容至2 000 mL, 磷酸调节pH至7.40后经0.22 μ m滤膜过滤, 备用。
碳酸酐酶和甲状腺球蛋白混合标准溶液:精密称取碳酸酐酶和甲状腺球蛋白冻干粉末, 分别使用0.1 mol/L磷酸缓冲液(pH 7.40)溶解后定容, 使两种标准蛋白储备液终浓度均为0.5 g/L, 分装后置于-80 ℃保存, 分析前将两种标准蛋白按照1 :1混合制成混合标准溶液, 取20 μ L进样。
高、低密度脂蛋白标准混合溶液:使用0.1 mol/L磷酸缓冲液(pH 7.40)将规格为10.0 mg的高密度脂蛋白和低密度脂蛋白分别溶解后制成终浓度为4.0 g/L的标准储备液, 分装后置于-20 ℃保存, 分析前将两种标准脂蛋白储备液按照1 :1混合制成脂蛋白标准混合溶液, 取20 μ L进样。
本研究中使用自组装非对称流场流分离系统, 通过切削一定厚度的聚酯薄膜隔片得到长度282.9 mm、宽度21.5 mm、总体积为1 160 μ L的分离通道, 横向流入口位于距离进样口188.8 mm处, 横向流出口位于分离通道的中间位置, 距离进样口141.5 mm(图1B)。通道上层为透明玻璃板构成的非渗透性消耗壁, 通道下层为渗透性的积累壁, 该积累壁由聚碳酸酯膜(孔隙0.1 μ m)、半透膜、聚四氟乙烯隔片(能够截止相对分子质量为10 000的蛋白)及不锈钢板构成。根据流场流分离原理中分析物保留时间与其Stoke’ s粒径的关系[见公式(1)][2], 按照Dou等[14]的方法, 使用标准蛋白碳酸酐酶(29 000)和甲状腺球蛋白(660 000)对压制后的通道实际高度进行标定。
dH =
公式(1)中, dH为分离样品的流体动力学直径, Vc为通道横向流流速, V0为通道体积, η 为载液黏度, ω 为通道高度, kT为热力学常数, t0为死时间, tr为样品的保留时间。
根据AF4的原理及结构, 通道高度理论上等于切削通道所用的聚酯膜厚度, 虽然该高度是已知的, 但是在组装仪器过程中压制多层垫片导致通道的实际高度往往小于聚酯膜的原始厚度。根据AF4的分离原理[15], 通过分析物的保留时间可以得到其流体动力学粒径, 前提是已知通道实际高度, 因此使用已知粒径的标准蛋白根据公式(1)标定通道实际高度, 在碳酸酐酶和甲状腺球蛋白标准混合溶液的分离过程中, 样品聚焦(focus)时间、过渡时间、载液pH值等对分离效果(用分离度R表示)影响显著, 进行单因素考察后, 选择分离度R大于1.5且重复性良好的分离条件标定通道实际高度, 并对AF4用于蛋白分离的性能进行初步验证。
根据文献报道[16, 17, 18, 19, 20]及本课题组前期工作[21], 选取对脂蛋白标准混合样品分离影响较大的5种主要因素(分离总流速、聚焦时间、过渡时间、载液pH值、载液黏度及各因素合适的水平区间)进行四水平五因素的正交试验, 以分离度为效应指标, 通过16个条件组合综合优化高、低密度脂蛋白标准混合样品的分离条件, 所选取的因素及水平见表1。
| 表1 非对称流场流分离仪器分离高、低密度脂蛋白标准混合溶液的正交设计试验四水平五因素 Table 1 Five factors and four levels of orthogonal design test for the separation of standard lipoproteins (high density lipoproteins and low density lipoproteins) by asymmetrical flow field-flow fractionation |
实验中应用的聚焦方式为本课题组自行设计优化的聚焦/洗脱程序[20], 并使用标准蛋白考察其可行性。例如正交设计试验中5号组实验, 其聚焦/洗脱程序见表2, 控制载液泵入系统的总流速为3.50 mL/min, 总流速由A、B泵提供, 其中A泵为进样泵, B泵为横向流速控制泵, 通过改变总流速、A泵和B泵的流速比例, 使程序在聚焦时间内保持沿通道方向流速为0.20 mL/min, C泵接口位于通道下方, 将载液抽出通道并产生垂直于通道的横向流场, 分离全程保持恒定流出速度3.00 mL/min(使载液进入检测器流速保持为0.50 mL/min), 如表2中初始0~3.0 min即为聚焦时间(focusing time), 3.0~4.0 min对应过渡时间(transition time), 即系统由聚焦程序转换成洗脱程序的过渡时间, 4.00 min之后为洗脱过程(elution period)。在每次进样前, 均用超纯水以总流速4.00 mL/min(A、B泵各为50%), 横向流出速度3.00 mL/min(C泵)冲洗分离通道15.0 min, 然后用载液以当前分离流速条件平衡系统12.0 min, 随后进样并启动聚焦/洗脱程序。紫外检测器检测波长设置为280 nm。
| 表2 聚焦/洗脱程序 Table 2 Focusing/elution program |
流场流分离系统是根据分析物流体动力学粒径差异进行分离的, 使用该系统对蛋白进行分离时, 分离效果(分离度R)受载液条件及流速条件影响极为明显, 在多种影响因素中, 载液pH值、载液中表面活性剂浓度、聚焦时间、积累壁膜材的种类、横向流入速度(cross-in)及横向流出速度(cross-out)已在本课题组前期工作中进行过分析[21], 进行正交设计试验优化脂蛋白分离条件时, 发现载液黏度对脂蛋白分离的影响具有统计学差异, 因此在上述各影响因素的优化条件下, 针对载液黏度对脂蛋白分离效果的影响进行进一步考察。
本研究中选取羟丙基甲基纤维素(hydroxypro-pylmethylcellulose, HPMC)调节载液黏度, 在0.1 mol/L的磷酸缓冲液中分别加入0.00%、0.02%、0.05%、0.08%、0.10%、0.12%(质量分数)的HPMC, 使用磷酸调节溶液pH至7.20, 分别取各溶液10 mL, 在室温下以纯水为参比标准, 使用乌氏黏度计测定含有不同浓度HPMC的磷酸缓冲液的黏度[22]。使用正交设计试验中优化得到的流速条件对高、低密度脂蛋白标准混合物进行分离, 每次进样20 μ L, 检测波长为280 nm。
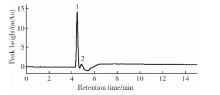
使用总流速3.00 mL/min, 横向流出速度 2.50 mL/min, 聚焦时间和过渡时间分别为3.5 min和1.0 min, 使用0.1 mol/L的磷酸缓冲液(pH=6.8)作为载液得到碳酸酐酶和甲状腺球蛋白标准混合样品的分离图见图2。根据单样品进样保留时间确定洗脱峰1为碳酸酐酶, 洗脱峰2为甲状腺球蛋白, 根据样品保留时间计算得到通道高度约为164 μ m。
使用正交设计试验, 优化高、低密度脂蛋白标准混合样品的分离条件, 得到16组分离度结果见表3。
| 表3 非对称流场流分离系统分离高、低密度脂蛋白标准混合样品的正交设计试验结果 Table 3 Orthogonal design test results of lipoproteins’ separation by asymmetrical flow field-flow fractionation |
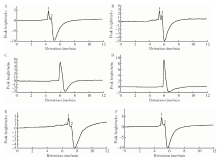
图3为AF4分离脂蛋白标准混合样品的分离图, 结合分离图图3和正交设计试验结果表3可以看出, 16个条件组合中共有2个条件组合(No.5和No.14)得到了大于1.50的分离度, 分别为1.58和1.61, 详见图3中A和B。除2个条件组合(No.7和No.8, 详见图3C和3D)只有单个混合洗脱峰以外, 其余12个条件组合均有两个明显的洗脱峰, 其中No.4和No.11均有较好的分离度(1.47和1.43), 详见图3E和3F。
对正交试验结果进行极差分析, 黏度的极差为1.14, 远大于其他4种因素的极差, 显示黏度对试验指标分离度的影响最大, 优先选取黏度的最佳水平即0.10 %的HPMC。在分离度指标下, 其余4种因素极差差别较小, 顺序为分离总流速> 载液pH值> 聚焦时间> 过渡时间。得到优化后的条件组合为:使用HPMC为0.10 %(质量分数)、pH值为6.80的磷酸缓冲液(0.1 mol/L)作为分离载液, 以4.5 mL/min的总流速进行分离, 设置聚焦时间为3.5 min, 过渡时间为1.5 min, 得到高、低密度脂蛋白标准混合物的最佳分离度为1.61。
进一步对试验结果进行方差分析, 将试验结果的总离差平方和分解为各因素误差的离差平方和, 通过求出各F值进而作F检验。由于正交表中未留出空白列, 根据正交设计试验方差分析规则, 选取五个因素中离差平方和最小者对随机误差引起的离差平方和作近似估计, 结果见表4, 在分离度指标下, 只有载液黏度的F值大于3.29[F0.05(3, 15) = 3.29], 差异具有统计学意义, 其P值远小于0.05, 对试验结果影响显著。按方差分析法的观点, 只须对差异有统计学意义的因素(载液黏度)确定好水平, 而其他对试验结果没有显著性影响的4个因素可按照实际需要来确定水平, 各因素水平的确定与极差分析方法相同。
| 表4 五因素单因素方差分析 Table 4 Results of five factors’ One-Way ANOVA |
从AF4的分离图(图3)中可以观察到, 虽然方差分析结果显示过渡时间对分离度无显著性影响, 但是过渡时间对峰形影响较为明显, 峰宽与过渡时间呈正相关关系, 过渡时间为0.5 min时, HDL平均半峰宽为0.16 min, 过渡时间为2.0 min时, HDL平均半峰宽增至0.22 min, 据此观察缩短过渡时间可有效改善峰形, 但不宜过短, 因为Ahn等[16]在对非对称流场流分离通道形状和尺寸进行优化时发现, 通道内载液流速沿通道长度方向的均匀性对分离效率影响很大, 使用较短的过渡时间可将在聚焦时间内达到纵向分布的颗粒快速推离通道, 但由于进样泵与横向流出泵比例变化过大, 速度骤增, 会严重影响分离系统的稳定性, 因此选取1.0 min作为优化后的过渡时间。
正交试验极差分析和方差分析得到的一致性结论为载液黏度对AF4分离效率的影响差异具有统计学意义。载液黏度越高(HPMC浓度越高), 高、低密度脂蛋白混合标准样品分离度越大, 正交试验中HPMC浓度为0.10 %的试验组分离度均大于1.40, 但同时观察到随着载液黏度的增加, 负峰现象有严重化的趋势, 为了验证载液黏度对AF4分离效果的影响, 故采取进一步的单因素分析。
为了验证载液黏度对AF4分离效果的影响, 通过加入不同浓度的HPMC得到6个黏度水平, 分别为1.05× 103 Pa· s、1.08 × 103 Pa· s、1.10 × 103 Pa· s、1.12 × 103 Pa· s、1.14× 103 Pa· s和1.17 × 103 Pa· s(1 Pa· s=103 cP)。
根据正交设计实验优化结果, 选取3.5 min聚焦时间和1 min过渡时间, 考察载液不同黏度水平下, 高、低密度脂蛋白标准混合样品的分离情况, 结果见图4。在所考察的黏度范围内(HPMC浓度从0.00%至0.12%), 脂蛋白混合物的分离度随着载液黏度的增加先增后减, 在0.05%浓度下得到较优分离效果。根据公式(1), 同等条件下, 对于粒径差异一定的混合样品颗粒, 保留时间与载液黏度成正比, 由公式(1)进一步推出:
Δ tr=tr2-tr1=
保留时间之差随着黏度的增大而增大, 故分离度在一定范围内会随黏度增加而增加, 根据黏滞定律, 相邻流层内摩擦力的大小与黏度成正比, 当黏度过大时, 流层间内摩擦力增大, 会对分离起到阻碍作用, 进一步的解释仍需理论推导和实验验证。
从黏度考察结果中可见, 负峰随黏度升高而呈增大趋势, 未添加HPMC的试验组基线平稳。从紫外吸收差异的角度进行了实验, 实验中使用含有HPMC的磷酸缓冲液和空白磷酸缓冲液作为载液, 在相同运行条件(A、B泵总流速为4 mL/min, C泵流速为3 mL/min)下, 考察HPMC的加入对磷酸缓冲液载液基线的影响, 结果显示, 磷酸缓冲液的紫外吸收值随着加入HPMC浓度的增加而升高, 其中含有0.10%HPMC的磷酸缓冲液紫外吸收值高于空白磷酸缓冲液约15.73 mAu。从分子结构角度进一步分析, HPMC是一种非离子型纤维混合醚, 理论上其分子结构中没有生色团, 而HPMC的水解产物中含有醛基, 会产生较为强烈的紫外吸收, 若HPMC发生部分水解则会提高载液的紫外吸收。此外, 根据不同厂家提供的生产工艺, HPMC中可能有异丙醇、环氧丙烷、氯甲烷、甲苯、丙二醇、甲醇、冰醋酸等有机溶剂残留[23], 以上原因可能导致了HPMC的加入使得载液的紫外吸收增强。实验中每次进样前均使用该条件载液(含不同质量浓度HPMC)平衡, 基线归零, 所以样品响应值是以该条件载液为参比的, 而样品统一采用pH7.40的磷酸缓冲液溶解分装后置于-80 ℃保存, 该缓冲液不含HPMC。在洗脱程序中, 有强烈紫外吸收信号的样品经过紫外检测器产生样品峰, 溶解样品所用的磷酸缓冲液相当于将载液中的HPMC浓度稀释, 相对于载液调零的基线其吸收值则为负, 从而紧随目标物质峰产生负峰。接下来的实验中需要进一步优化操作并寻找替代材料以减小负峰对定量结果的影响。在非对称流场流分离系统的理论研究领域仍存在广阔的探索空间, 精确量化分析仍是自组装仪器进一步优化的重点和难点。
自组装非对称流场流分离仪器可根据颗粒的粒径差异对蛋白和脂蛋白进行有效分离, 得到通道实际高度为164 μ m, 使用正交设计试验法对脂蛋白混合物分离条件进行优化, 在优化的条件下可实现高、低密度脂蛋白的分离度大于1.50, 对正交设计试验结果进行直观分析和方差分析得出载液黏度的影响具有统计学意义, 进一步验证载液黏度对AF4分离效果的影响, 观察到随着载液黏度的增加, 负峰呈增大趋势。本研究通过实验和统计学分析证实自组装非对称流场流仪器用于脂蛋白分离的可行性, 其快速、简便、样品无需前处理的特点在临床诊断等应用中具有很大潜力, 但是目前自组装仪器还存在一些待优化问题, 在接下来的研究中将继续开展对仪器硬件方面的优化和联用技术的发展。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|