目的: 观察炎症因子预处理脂肪干细胞(adipose derived stem cells,ASCs)模拟异常炎症环境能否增强ASCs抑制外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)体外增殖的能力。方法: 先用酶消化法对ASCs进行分离及体外培养,流式细胞仪检测其表面CD分子表达情况,用特定培养基诱导分化并鉴定其向脂肪组织和骨组织分化的能力。将PBMCs用CFSE标记后,与炎症因子预处理后的ASCs共培养,对照组无ASCs或使用未经炎症因子处理的ASCs,同时用CD3/CD28刺激PBMCs增殖,最后用流式细胞仪检测PBMC的母代细胞比例,从而判断其增殖情况。结果: ASCs形态为梭形,密集时可成鱼群状生长,可在诱导培养基培养下向脂肪组织和骨组织分化,表面CD分子表达情况与国际脂肪治疗联盟的关于ASCs的说明一致。PBMCs与ASCs体外共培养后,与无ASCs组相比,PBMCs的母代细胞比例有所增加,但效果并不显著,而将PBMCs与用炎症因子预处理后的ASCs共培养,PBMCs的母代细胞比例有明显增加(炎症因子处理后ASCs组 38.7%±10% vs. 无ASCs组28.4%±8.9%, P<0.05), 说明炎症因子预处理的ASCs可明显抑制PBMCs的增殖。结论: 炎症因子可增强ASCs的抗炎能力,该发现有助于ASCs更好地在组织修复领域发挥治疗作用。
Objective: To explored whether adipose derived stem cells (ASCs) could inhibit the pro-liferation of peripheral blood mononuclear cells (PBMCs) and whether inflammatory priming could enhance this property of ASCs.Methods: We isolated ASCs using collagenase from adipose tissue and expanded them in vitro. Cells were induced to differentiate into adipogenic and osteogenic lineages. The cells at passage 3 to passage 5 were used for the experiments. After carboxy fluoresce in succinimidyl ester (CFSE) staining, PBMCs were co-cultured with inflammatory priming ASCs. The PBMCs cultured without ASCs or with non-treated ASCs defined as control groups. Then we used flow cytometry to detect the proliferation of PBMCs.Results: ASCs had fibroblast-like phenotype and were spindle shaped. They were able to differentiate into cells of adipogenic and osteogenic lineages in specific induction media. ASCs had the CD expression profile consistant with the International Federation for Adipose Therapeutics statement. The percentage of parent cells in PBMC after co-cultured with ASCs increased, though there was no statistical significance. However, when co-cultured with inflammatory priming ASCs, the percentage of parent cells significantly increased (with inflammatory priming ASCs group vs. without ASCs group, 38.7%±10.0% vs. 28.4%±8.9%, P<0.05). This indicated that inflammatory priming ASCs could significantly inhibit the proliferation of PBMCs.Conclusion: Inflammatory cytokines can enhance the immunosuppressive ability of ASCs. Our findings may help the application of ASCs in tissue repairment with better results.
近年来, 脂肪组织作为获取间充质干细胞(mesenchymal stem cells, MSCs)的有效来源而获得越来越多的关注。与骨髓相比, 脂肪组织很丰富, 且位置表浅, 容易获取, 而且脂肪组织中MSCs的丰度要高于骨髓组织, 1 g脂肪组织约可获取2× 106个细胞, 其中脂肪干细胞(adipose derived stem cells, ASCs)的比例可高达10%[1]。在细胞治疗领域, 如何获取足量的细胞往往是治疗上的限制因素, 而脂肪组织作为干细胞的潜在替代来源具有极大优势。
已有多项动物实验研究使用ASCs进行泌尿系器官的修复, 如Castiglione等[2]证实ASCs可减轻大鼠尿道损伤后狭窄的发生, Wang等[3]将ASCs种植在丝素蛋白和自体成肌细胞组成的支架上, 用于修补大鼠的膀胱缺损, 可部分恢复其膀胱的结构和功能, 另外, 还有研究将ASCs与平滑肌细胞负载于膀胱去细胞基质, 成功重建了兔的输尿管[4]。
炎症在组织损伤修复过程中扮演着重要角色, 减轻炎症反应可加速组织修复。多数研究发现骨髓间充质干细胞(bone marrow-mesenchymal stem cells, BMSCs)在体内外显示出抗炎特性, 并可调节受体的免疫反应[5, 6, 7], 这一特性提示细胞可以通过调节免疫反应发挥治疗作用, 包括用于组织再生和器官移植。由于BMSCs和ASCs的相似性, ASCs可能也具有通过免疫抑制调控宿主免疫反应的能力。已有文献报道ASCs可分泌多种炎症调节因子, 包括白细胞介素(interleukin, IL)-6、IL-8、粒细胞集落刺激因子、粒细胞巨噬细胞刺激因子和单核细胞趋化蛋白等[8]。另外, 体外实验证实ASCs可抑制混合淋巴细胞反应[9]。
增强ASCs的免疫调节功能可更好地发挥其促进组织修复的能力。有文献报道BMSCs在干扰素(interferon, IFN)-γ 和肿瘤坏死因子(tumor necrosis factor, TNF)-α 刺激下对T细胞增殖有抑制作用[10]。本文拟探讨在炎症因子刺激下, ASCs的抗炎能力是否也会得到增强。
脂肪组织取自3例北京大学第一医院尿道狭窄手术患者, 用于提取ASCs行原代细胞培养; 外周血取自健康志愿者, 用于分离人外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)。本研究经北京大学第一医院临床研究伦理委员会批准(2017[420])。
1.2.1 清洗 取皮下脂肪约10 mL, 预热磷酸盐缓冲液(phosphate-buffered saline, PBS)至37 ℃, 用长镊将脂肪转移至PBS中, 摇晃后静置1 min, 用移液管吸弃下层液体, 再倒入适量(50~100 mL)PBS, 反复清洗至颜色变清(约3~5次)。
1.2.2 消化 将脂肪转移至培养皿中, 把明显的血管和电刀灼伤组织剔除, 初步将脂肪剪小, 再加入2 mL胶原酶消化液(美国Gibco), 用剪刀快速剪碎后转移至50 mL离心管中, 补加等体积胶原酶消化液, 放入37 ℃摇床消化, 75 r/min消化1 h, 每5~10 min上下颠倒混匀。
1.2.3 离心 消化完成后, 1 300 r/min离心3 min(后续离心所用参数相同), 取出剧烈摇动10 s, 再次离心, 小心吸弃上层脂肪组织和消化液, 加入培养基至10 mL, 重悬沉淀转移至15 mL离心管中, 离心, 小心吸弃上层液体, 用培养基再次洗涤后离心弃上清, 用培养基重悬沉淀, 移入培养皿。48 h后换液。第3~5代细胞用于后续实验。
1.3.1 成脂分化及油红O染色 脂肪干细胞在成脂培养基中培养2周。成脂培养基成分:DMEM培养基、10%(体积分数)胎牛血清、1 μ mol/L地塞米松、10 μ mol/L胰岛素、200 μ mol/L吲哚美辛及0.5 mmol/L 3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methyl-xanthine, IBMX)。油红O染色验证成脂分化能力:细胞室温下用40 g/L多聚甲醛固定1 h, 用70%(体积分数)乙醇漂洗, 室温下用油红O试剂(北京索莱宝公司)孵育3~5 min, 再用去离子水漂洗3遍, 苏木素复染核。
1.3.2 成骨分化及Von Kossa染色 利用商品化成骨分化培养基(美国Gibco)诱导ASCs向成骨细胞分化。诱导3周后, 用Von Kossa染色验证成骨分化能力:细胞在室温下用40 g/L多聚甲醛固定1 h, 去离子水漂洗3遍, 用Von Kossa染液(北京雷根)在紫外光照射下染色10 min。
加入3 mL Ficoll-paque plus(美国GE)于15 mL离心管管底, 倾斜离心管, 小心贴壁加入4 mL全血于上层。室温400× g离心30 min, 加减速度均设置为0。小心抽取中间层细胞, 加入3倍体积的PBS清洗, 100× g离心10 min, 此时加减速设置恢复正常。6 mL PBS再次清洗, 离心。弃上清, 用3 mL Roswell Park Memorial Institute(RPMI)1640培养基重悬后, 铺于6 cm培养皿中。
采用多种细胞因子混合的方法模拟炎症环境, 各细胞因子在培养基中的浓度如下:IFN-α 10 μ g/L、IFN-γ 50 μ g/L、TNF-α 50 μ g/L、IL-1β 25 μ g/L(均购于北京达科为公司), 用含上述因子培养基培养过夜后, 进行后续实验。
取5× 105个外周血单个核细胞, 用PBS补足至1 mL。加入0.2 μ L CFSE储存液(美国Life), 使得CFSE的终浓度为1 μ mol/L。混匀, 37 ℃避光孵育20 min, 期间每隔5 min上下颠倒混匀, 使染色均匀。加入5 mL完全培养基, 37 ℃ 5 min。离心, 弃上清, 加入200 μ L完全培养基, 加入96孔板孔中培养或流式检测。
ASCs消化后计数, 以1× 104个细胞/孔接种于96孔板中。待24 h后ASCs贴壁, 配置含丝裂霉素C的培养基(丝裂霉素C终浓度为10 mg/L), 换用该培养基培养2 h后, 用PBS清洗5遍。正常组ASCs用正常完全培养基培养(DMEM培养基+10%胎牛血清), 炎症因子组换用含有炎症因子的完全培养基培养。12 h后两组细胞均弃去培养基, 并加入CFSE标记过的PBMCs, 细胞数为1× 105个。培养基含有CD3/CD28抗体(北京同立海源公司)及IL-2, 可刺激T细胞增殖。培养3 d后流式细胞仪检测PBMCs的增殖情况。
使用统计软件SPSS 20.0用于数据分析, 计量资料用均数± 标准差表示, 两独立样本采用Student’ s t检验, P< 0.05被认为差异有统计学意义。
培养至第3代的ASCs被用于本研究。ASCs为贴壁生长, 在倒置光学显微镜下观察为梭形细胞, 细胞密集时可呈鱼群样生长(图1A)。在特定培养基的诱导培养下, 细胞具有向脂肪组织和骨组织分化的能力。Von Kossa染色证实, 在成骨培养基诱导3周后, 细胞内部有钙盐沉积, 提示ASCs具有成骨分化能力(图1B)。油红O染色证实, 用成脂培养基诱导2周后细胞内有脂滴形成, 提示ASCs还具有成脂分化的能力(图1C)。另外, 流式细胞检测结果显示ASCs表面间质组织的一些标志物阳性表达, 如CD44、CD73、CD90和CD105, 阳性率超过90%; 而造血细胞相关标志物, 如CD31和CD45为阴性表达, 阳性率小于2%(图2)。这些结果与国际脂肪治疗联盟(International Federation for Adipose Theraputics, IFATS)关于ASCs表面分子表型的说明一致。
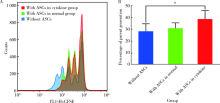
为验证ASCs在体外具有免疫抑制能力, 本研究将ASCs与PBMCs共培养, 用CD3/CD28刺激单个核细胞增殖3 d后, 发现与不加入ASCs相比, 与ASCs共培养组的PBMCs母代细胞的比例升高, 但升高并不明显(ASCs组30.9%± 6.4% vs. 无ASCs组28.4%± 8.9%, P> 0.05), 说明ASCs体外有能够抑制PBMCs增殖的趋势。考虑其在发挥免疫抑制能力时周围环境实际上是处于炎症激活状态的, 为探索在炎症条件下ASCs的免疫抑制作用会发生何种改变, 本研究将ASCs用炎症因子(IFN-α 、IFN-γ 、TNF-α 、IL-1β )处理后再与PBMCs共培养, 发现与不加入ASCs相比, PBMCs母代细胞的比例有明显提高(炎症因子处理后ASCs组38.7%± 10.0% vs. 无ASCs组28.4%± 8.9%, P< 0.05), 提示ASCs经炎症因子处理后能明显抑制PBMCs的增殖(图3)。
2004年有文献报道1例9岁男孩使用基于BMSCs的疗法成功治疗了移植物抗宿主病[11]。自此, 越来越多研究者开始利用BMSCs治疗自身免疫性疾病, 并在临床上取得了疗效, 提示BMSCs具有免疫调节特性。与BMSCs相似, ASCs也在体内外被证实有免疫调节作用, 有研究者用人ASCs治疗鼠关节炎疾病模型, 当在疾病起始阶段注入细胞治疗后, 可完全阻止疾病进展, 而当关节炎已经形成后再注入细胞治疗, 仍然可以减轻关节炎的严重程度, 细胞治疗组的关节组织中各种炎症细胞因子或趋化因子的表达明显下调(如趋化因子配体5和巨噬细胞炎症蛋白2), 同时抗炎相关细胞因子(如IL-10)表达上调[12]。另外, 该研究还表明, ASCs可部分抑制CD4+T细胞向炎症性的Th1细胞分化而产生更多分泌IL-10的调节性细胞。ASCs展现出的抗炎作用也促使研究者将其进一步应用于临床治疗, 最为著名的研究可能就是将其用于克罗恩病(Crohn’ s disease)患者复杂性肛周瘘的治疗[13]。
除了自身免疫性疾病, 炎症在组织损伤修复中也起到重要作用, 过低水平的炎症会引起细菌等外部致病因素对组织的再次损伤, 而慢性持续性的炎症会阻碍组织的修复并发生纤维化, 引起器官的功能障碍[14]。尿道狭窄是尿道内腔的内径变窄, 表现为尿道上皮及尿道周围组织的慢性纤维化, 这一病理变化即与异常炎症有关。本团队前期利用ASCs负载在异种真皮去细胞基质修复兔的尿道缺损, 术后6个月可见新生尿道上有平滑肌长入和多层尿道上皮覆盖, 均无再狭窄或尿瘘发生[15]。Castiglione等[2]也利用ASCs修复大鼠的尿道损伤, 发现在损伤组织中炎症因子诱导表达的促纤维化因子(包括血小板源生长因子β 、内皮因子及整合蛋白β 3)均有下降。这些研究结果间接提示ASCs的抗炎作用在尿道组织修复中扮演了重要角色, 理论上, 增强ASCs的抗炎能力可增强组织修复能力, 加快损伤愈合。
本研究证实, ASCs在体外有抑制PBMCs增殖的趋势, 但效果并不显著。考虑到组织损伤修复过程中, 即使没有细菌或其他微生物感染, 组织损伤及细胞死亡也会诱发无菌性的炎症, 我们在体外用多种炎症因子处理ASCs, 模拟在体内的炎症环境, 观察其对PBMCs增殖的影响, 结果发现经过刺激后的ASCs的免疫抑制能力明显增强。Ren等[10]在研究鼠BMSCs的抗炎作用时也发现类似现象, 当T细胞与BMSCs共培养时, 其在IL-2存在下的增殖能力并没有受到抑制, 因此, 认为在没有T细胞产生的细胞因子刺激下, BMSCs并不会抑制T细胞的增殖, 但当T细胞激活并产生细胞因子时, BMSCs的抑制作用就会显现, 另外, 当存在IFN-γ 和TNF-α (或IL-1)时, BMSCs也会发挥其抑制作用。该团队进一步分析了细胞因子刺激后BMSCs发挥抑制T细胞增殖的机制, 发现与一氧化氮的生成有关, 当加入抑制一氧化氮生成的药物后, T细胞的增殖能力得到恢复。具体ASCs在炎症因子刺激下抗炎作用增强的机制还有待进一步研究。
综上, 本研究得出结论:在一系列炎症因子(IFN-α 、IFN-γ 、TNF-α 及IL-1β )刺激下ASCs的抗炎能力会得到增强, 可将ASCs用炎症因子预处理后再利用其进行组织修复治疗(比如尿道损伤的修复)。另外, 进一步研究ASCs抗炎能力增强的机制, 可有助于其更好地应用于临床。
(本文编辑:赵 波)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|