目的: 初步探索γδT细胞在抗膀胱癌过程中的作用及其识别的应激蛋白MICA/B在膀胱癌中的表达情况。方法: 经帕米磷酸二钠体外扩增培养膀胱癌患者外周血来源的γδT细胞,利用流式细胞术检测γδT细胞的纯度、扩增效率和经佛波酯/离子霉素(PMA/ionomycin)刺激后CD107a的表达,通过细胞毒实验检测其对膀胱癌细胞株的细胞毒作用;采用流式细胞术和免疫组织化学染色法分别检测膀胱癌细胞株表面和膀胱癌组织中MICA/B蛋白的表达情况。结果: 成功扩增6例膀胱癌患者外周血γδT细胞,纯度达75%~94%,γδT细胞绝对数达到初始的109~371倍。经PMA/ionomycin刺激后,表达CD107a的γδT细胞比例明显增加,可达40%~82%,膀胱癌患者的γδT细胞对3株膀胱癌细胞株都有显著的细胞毒作用,且随效靶比增高而增强。3株膀胱癌细胞株表面和26例膀胱癌组织中均不同程度地表达MICA/B,浸润性膀胱癌中MICA/B的染色评分略高于非浸润性膀胱癌,高级别膀胱癌中MICA/B的染色评分要高于低级别膀胱癌,但统计学分析显示组织中MICA/B的染色评分与肿瘤分期、分级没有显著相关性。结论: 膀胱癌患者外周血γδT细胞可在体外成功扩增,并显示出显著的抗膀胱癌作用,膀胱癌细胞和组织中都不同程度表达MICA/B,但统计学分析显示MICA/B在膀胱癌组织中的染色评分与肿瘤分期、分级没有相关性。
Objective: To explore the role of γδT cells against bladder cancer and to detect the expression of stress proteins MICA/B recognized by γδT cells in bladder cancer.Methods: γδT cells from peripheral blood drawn from 6 bladder cancer patients with pamidronate stimulating were expanded. Flow cytometry was used to detect the purity and expansion folds of γδT cells, and the expression of CD107a on γδT cells after PMA/ionomycin stimulated. The cytotoxicity assay was carried out to test the cytotoxi-city of γδT cells against human bladder cancer cell lines. The expression of MICA/B on bladder cancer cell lines and in bladder cancer tissues were detected through flow cytometry and immunohistochemistry respectively.Results: γδT cells from peripheral blood drawn from 6 bladder cancer patients were successfully expanded. The purity was 75%-94% and the expansion folds were 109-371 times. After being stimulated by PMA/ionomycin, the proportion of CD107a+ γδT cells increased significantly, reaching 40%-82%. γδT cells from the 6 bladder cancer patients showed obvious cytotoxic effects on 3 human bladder cancer cell lines which was enhanced as the effector: the target ratio increased. MICA/B were detected both in 3 bladder cancer cell lines and in 26 bladder cancer tissues. The staining score of MICA/B in invasive bladder cancer was slightly higher than that in non-invasive bladder cancer, and in advanced bladder cancer was higher than that in low grade bladder cancer, but the statistical analysis showed that the staining score of MICA/B was no significant correlation between the tissue and the tumor stages and grades.Conclusion: γδT cells from the peripheral blood of the bladder cancer patients could be successfully expanded in vitro, and showed significant anti-bladder cancer effect. MICA/B were detected both in bladder cancer cell lines and in bladder cancer tissues. The statistical analysis showed that there was no significant correlation between the staining scores of MICA/B in the tissue and the tumor stages and grades.
膀胱癌是我国泌尿系统最常见的肿瘤之一, 非肌层浸润性膀胱癌占膀胱癌患者的75%~85%, 大多可通过经尿道电切术及术后辅助膀胱灌注化疗得到有效治疗, 但肿瘤复发率仍高达30%~70%, 而且约30%非肌层浸润性膀胱癌患者最终进展为肌层浸润性膀胱癌, 约20%的患者初始诊断即为肌层浸润性膀胱癌。肌层浸润性膀胱癌患者需行根治性膀胱切除术, 5年生存率仅50%, 其余患者多在2年内出现肿瘤转移, 预后较差。
在手术、放疗和化疗效果都极其有限的情况下, 免疫治疗成为肿瘤治疗的第4种选择。随着程序性死亡受体-1(programmed death-ligand 1, PD-L1)单克隆抗体被用于肿瘤治疗[1, 2], 肿瘤免疫治疗受到了研究者们前所未有的关注, 有望突破肿瘤治疗的瓶颈。
γ δ T细胞是固有免疫系统和适应性免疫系统的桥梁, 具有以主要组织相容性复合体(major histocompatibility complex, MHC)非限制性方式直接识别多种肿瘤相关抗原, 广谱抗肿瘤活性, 兼具自然杀伤细胞(natural killer cell, NK)、细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTL)和T辅助细胞(T helper cells, Th)的功能特点, 以及体外扩增无需肿瘤抗原刺激等优点, 因此成为肿瘤免疫治疗的研究热点[3, 4]。
MHC-Ⅰ 类相关蛋白A/B(MHC class Ⅰ chain-related protein A/B, MICA/B)是人类MHC-Ⅰ 类分子链相关基因A编码的多态性细胞膜糖蛋白分子, 该基因的分子结构与MHC-Ⅰ 类分子很相似, 不同之处在于MICA/B分子不与β 2微球蛋白结合, 也不提呈抗原肽[5]。MICA/B能被自然杀伤细胞2族成员D受体(natural killer group 2, member D, NKG2D)识别, 从而介导表达NKG2D的γ δ T细胞和NK细胞发挥杀伤功能, 因此, MICA/B-NKG2D的相互作用是γ δ T细胞过继免疫治疗肿瘤的一条重要途径。
为了初步探索γ δ T细胞在膀胱癌免疫治疗中的作用, 本研究通过体外扩增培养, 确定经膀胱癌患者外周血获得具有高纯度和抗膀胱癌活性γ δ T细胞的可行性, 并检测膀胱癌细胞株和膀胱癌组织中MICA/B的表达水平。
人膀胱癌细胞株RT4、T24购自美国模式培养物集存库(American type culture collection, ATCC), BIU87由北京大学泌尿外科研究所提供。胎牛血清(fetal bovine serum, FBS)购自达科为生物技术有限公司(货号6021011), RPMI-1640培养基、0.25%(质量分数)胰蛋白酶购自美国Gibico公司, 淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司, 帕米膦酸二钠购自瑞士Norvartis公司, 重组人白细胞介素2 (interleukin 2, IL-2)购自北京瑞得合通药业有限公司, 佛波酯(phorbol 12-myristate 13-acetate, PMA)、离子霉素(ionomycin)购自达科为生物技术有限公司。藻红蛋白(phycoerythrin, PE)标记的抗人MICA/B抗体、PE标记的抗人T细胞受体(T cell receptor, TCR) α β 抗体、异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的抗人TCR γ δ 单克隆抗体、别藻蓝蛋白(allophycocyanin, APC)标记的抗人CD107a抗体购自美国Biolegend公司, 免疫组织化学用MICA/B抗体购自Santa Cruz公司, 乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)抗原修复液、羊血清封闭液、免疫组织化学用二抗(PV6000)和二氨基联苯胺(3, 3’ -diaminobenzidine, DAB)显色液购自北京中杉金桥生物技术有限公司, CytoTox 96® Non-Radioactive Cytotoxi-city Assay试剂盒购自美国Promega公司。
本研究所用的膀胱癌患者肿瘤组织和外周血均来自北京大学人民医院泌尿外科, 纳入研究的患者需满足以下条件:(1)符合膀胱癌诊断标准, 组织病理学诊断为膀胱癌; (2)术前未接受放化疗; (3)通过患者的病史、系统的体格检查、相关的实验室检查和影像学检查等资料, 排除其他肿瘤以及脑梗塞、心肌梗死、充血性心力衰竭等严重疾病, 排除自身免疫性疾病等。本研究获得北京大学人民医院医学伦理委员会审批通过(批件号2017PHB122-01)。
膀胱癌细胞株RT4、T24和BIU87分别培养于含10%(体积分数)灭活FBS的RPMI-1640培养基中, 置于37 ℃、5%(体积分数)CO2条件下培养, 每3天换一次液, 当细胞达到80%融合度时, 用 0.25%(质量分数)胰酶消化处理, 按体积比1 :3传代。
将石蜡组织切片65 ℃烤1 h, 二甲苯脱蜡, 5 min/次, 共4次, 依次放入无水乙醇、95%(体积分数)乙醇溶液、75%(体积分数)乙醇溶液中各20 s, 最后放于水中, 以pH 8.0的EDTA抗原修复:95 ℃ 20 min, 之后用磷酸盐缓冲液(phosphate buffer saline, PBS)洗3次, 3 min/次, 滴加3%(体积分数)H2O2于组织上, 作用3 min, 用PBS洗3次, 3 min/次, 10%(体积分数)羊血清室温封闭30 min, 滴加一抗(mouse anti-human MICA/B), 体积比为 1 :200, 4 ℃孵育过夜, PBS洗3次, 3 min/次, 滴加二抗, 室温孵育20 min, PBS洗3次, 3 min/次, DAB显色, 复染核, 封片。
免疫组织化学结果评分标准:(1)按染色强度分为0~3分; (2)计算阳性细胞百分比:阳性细胞数< 5%为0分, 5%~25%为1分, 25%~50%为2分, 50%~75%为3分, > 75%为4分; (3)染色强度× 阳性细胞百分比所得的值作为评分依据:0~1为阴性, 2~4为+, 5~8为++, 9~12为+++。
取膀胱癌患者外周血, 利用密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell, PBMC), 将PBMC加入到24孔培养板中, 加入帕米磷酸二钠(10 μ mol/L)、IL-2(100 IU/mL)进行培养, 5 d后换新鲜完全培养基(RPMI-1640+10% FBS+IL-2)并传代, 之后隔天传代一次, 15 d左右采用流式细胞术检测细胞纯度并进行后续实验。γ δ T细胞体外扩增效率的计算:扩增效率=(培养后细胞总数× γ δ T细胞占细胞总数的比例)/(PBMC总数× γ δ T细胞占PBMC的比例)[6]。
收集约1× 106个细胞, 以含1%(体积分数)牛血清白蛋白(bovine serum albumin, BSA)的PBS洗涤2次, 加入适量荧光标记抗体, 4 ℃避光孵育20 min, PBS洗液洗涤2次, 重悬于500 μ L含1%(体积分数)多聚甲醛溶液的PBS固定液中用于流式细胞仪分析。
采用完全培养基重悬γ δ T细胞至1× 106个细胞/mL, 加入20 μ g/L的PMA和0.5 mg/L的ionomycin。将细胞置于37 ℃、5% CO2饱和湿环境孵育6 h, 收集细胞, 加入5 μ L anti-CD107a, 4 ℃避光孵育20 min, PBS洗液洗涤2次, 重悬于500 μ L含1%多聚甲醛的PBS固定液中用于流式细胞仪分析。
按照CytoTox 96® Non-Radioactive Cytotoxicity Assay试剂盒说明书操作, 收集膀胱癌细胞株RT4、T24、BIU87作为靶细胞, 以培养15 d的膀胱癌患者外周血来源的γ δ T细胞为效应细胞, 效靶比(effector :target)分别为1 :1、5 :1、10 :1。效应细胞和靶细胞混合后, 于37 ℃、5% CO2条件下培养4 h, 收集培养上清液用于乳酸脱氢酶释放量的测定。杀伤效率计算公式如下[6]:杀伤效率=(实验孔值-效应细胞自发释放孔值-靶细胞自发释放孔值)/(靶细胞最大释放孔值-靶细胞自发释放孔值)× 100%。
采用SPSS 23.0软件进行统计学分析, 免疫组织化学染色的结果分析采用Fisher’ s精确概率检验, P< 0.05为差异有统计学意义。
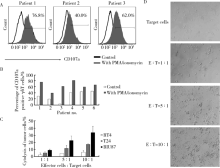
由表1可见, 6例膀胱癌患者中, 低级别膀胱癌2例, 高级别4例, 女性1例, 男性5例。在帕米磷酸二钠活化刺激下, 经15 d体外扩增培养, 来自于膀胱癌患者外周血的6例γ δ T细胞纯度可达75%~94%(图1A~C), γ δ T细胞绝对数达到初始γ δ T细胞的109~371倍(图1D), 经帕米磷酸二钠体外活化扩增, 可从膀胱癌患者外周血中获得纯度较高的γ δ T细胞。
| 表1 6例膀胱癌患者的临床信息 Table 1 Clinical characteristics of 6 patients with bladder cancer |
如图2A、B所示, 经PMA/ionomycin刺激后, γ δ T细胞中表达CD107a的细胞比例明显增加, 比例可达40%~82%。6例膀胱癌患者外周血体外扩增的γ δ T细胞对3种膀胱癌细胞株RT4、T24、BIU87都有不同程度的细胞毒作用, 且细胞毒作用随着效靶比增加而增高(图2C)。当效靶比为1 :1时, 共培养孔中肿瘤细胞的形态接近于未加效应细胞的靶细胞孔, 呈梭形, 随着效靶比增高, 共培养孔中肿瘤细胞的形态大多呈圆形, 部分肿瘤细胞皱缩、破碎。
如图3所示, 3种膀胱癌细胞株都不同程度表达MICA/B, 其中RT4表达MICA/B的细胞比例最高, 阳性细胞百分比达到 78.10%, T24和BIU87中MICA/B阳性细胞的比例分别为 4.88%和3.56%。
用于检测MICA/B表达的膀胱癌组织共26例, 其中16例> 70岁, 10例≤ 70岁, 男性15例, 女性11例, 非肌层浸润性(Ta/T1)膀胱癌患者15例, 肌层浸润性(T2/T3)膀胱癌患者11例, 低级别膀胱癌患者10例, 高级别膀胱癌患者16例。
免疫组织化学染色结果见图4。浸润性膀胱癌中MICA/B的染色评分略高于非浸润性膀胱癌, 高级别膀胱癌中MICA/B的染色评分要高于低级别膀胱癌(表2)。Fisher’ s精确概率检验结果显示, 膀胱癌组织中MICA/B的表达量与肿瘤分期(P=0.428)、分级(P=0.425)没有显著相关性。
 | 图4 免疫组织化学染色显示MICA/B在膀胱癌组织中的表达Figure 4 Immunohistochemical staining of MICA/B expression in bladder cancer tissuesA, low grade; B, high grade/non-muscle invasive; C, high grade/muscle invasive. |
| 表2 不同分期和分级的膀胱癌组织中MICA/B的染色评分 Table 2 MICA/B staining scores in different tumor stages and grades of bladder cancer |
γ δ T细胞仅占外周血CD3+T细胞的1%~10%, 大多数呈CD4和CD8双阴性, 少数表达CD8。与α β T细胞不同, γ δ T细胞通过其TCR和/或NKG2D受体广谱而特异性地识别一些非肽类抗原, 如MICA/B、UL16结合蛋白(unique long 16-binding proteins, ULBPs)[7]、热休克蛋白(heat shock proteins, HSPs)[8]等应激蛋白分子, 因此, γ δ T细胞对表达这些分子的肿瘤细胞和组织显示良好的细胞毒作用。现在越来越多的临床研究表明, 静脉注射磷酸抗原(如帕米磷酸二钠)或者将体外扩增的γ δ T细胞回输到患者体内, 都可以使患者体内的γ δ T细胞数量增加, 并表现出一定的抗肿瘤作用[9, 10, 11, 12, 13, 14]。帕米磷酸二钠是一种氨基二磷酸盐, 已有研究表明它是一种γ δ T细胞的活化剂[15]。
目前, 将γ δ T细胞用于肿瘤过继免疫治疗的研究涉及到了多种血液肿瘤和实体肿瘤, 其中针对胃癌、多发性骨髓瘤、非小细胞肺癌等肿瘤的研究已进行了临床试验并取得了较好的结果[12]。关于γ δ T细胞抗膀胱癌的研究报道较少, 有研究发现, γ δ T细胞缺陷小鼠在卡介苗灌注治疗后中性粒细胞的募集作用减弱, 相应的抗膀胱癌的作用也显著减弱[16], 静脉注射γ δ T细胞能有效阻止膀胱癌原位癌小鼠的肿瘤生长[17], 这些研究结果提示我们γ δ T细胞在抗膀胱癌过程中有重要作用。
本研究收集了6例膀胱癌患者外周血, 用帕米磷酸二钠体外扩增培养, 两周后检测发现, 6例患者的外周血γ δ T细胞都有不同程度扩增。为了检测其细胞毒作用, 我们分别采用了CD107a检测法和细胞毒实验。CD107a是淋巴细胞脱颗粒的标志物, 常被用于衡量淋巴细胞的细胞毒作用[18]。扩增的γ δ T细胞经PMA/ionomycin刺激后, 表达CD107a的细胞比例明显增加。细胞毒实验结果显示体外扩增的γ δ T细胞对3株膀胱癌细胞株均有不同程度的细胞毒作用, 且细胞毒作用随着效靶比增加而增强。由此可见, 膀胱癌患者外周血γ δ T细胞可以在体外进行有效扩增, 体外实验证实扩增培养的细胞具有显著的抗膀胱癌作用。
以往有研究表明, 大多数肿瘤(如肺、乳腺、肾、前列腺、卵巢、结肠、黑色素瘤等)都表达MICA/B[19, 20, 21, 22, 23, 24], 约75%的原发性皮肤黑色素瘤和50%转移性黑色素瘤表达MICA/B[24]。MICA/B在淋巴结转移Ⅰ 期结直肠癌组织标本中高表达, 但在Ⅱ 期、Ⅲ 期或Ⅳ 期肿瘤中低表达[25]。在结直肠癌患者中, MICA/B高表达者预后良好[23], 这说明MICA/B的高表达与患者预后良好有一定相关性。
关于MICA/B在膀胱癌中表达情况的研究较少, 本研究中, 流式细胞术检测发现3株膀胱癌细胞株表面均不同程度地表达MICA/B蛋白, 免疫组织化学染色检测可见26例膀胱癌组织中有MICA/B的表达, MICA/B的染色评分随着膀胱癌组织分期、分级增高有增高趋势, 但是经Fisher’ s精确概率检验, 膀胱癌组织中MICA/B的表达量与肿瘤分期、分级没有显著相关性, 这个结果可能有两个原因:(1)MICA/B的表达确实与膀胱癌的分期和分级没有相关性, (2)本研究样本量小导致未检出差异。在后续的研究中, 我们需要增加样本的收集力度, 将这部分研究进一步完善。
此外, 本研究发现细胞株RT4表达MICA/B的细胞比例明显高于T24和BIU87, 但是在同样的效靶比下, γ δ T细胞对RT4的细胞毒作用低于T24和BIU87, 这可能是因为MICA/B在细胞表面高表达的同时, 大量可竞争性结合NKG2D的可溶性MICA/B(即分泌型MIC蛋白)分泌到胞外[26], 与γ δ T细胞结合以后诱导细胞表面NKG2D表达下调, 这是肿瘤细胞保护自己的一种机制。乳腺癌、肺癌、结肠癌、卵巢癌、胶质瘤、神经母细胞瘤、白血病和黑色素瘤等多种肿瘤中都检测到可溶性MICA/B蛋白[27, 28, 29, 30]。因此, 本研究除了增加样本量确定组织中MICA/B表达与肿瘤分期、分级是否相关, 另一个需要我们重视的问题就是患者外周循环中MICA/B的表达情况。
综上所述, γ δ T细胞在抗膀胱癌过程中有一定的作用, 有可能成为膀胱癌免疫治疗中的关键成员, 但是MICA/B的表达在这个过程中是否起作用、扮演什么角色还需要进一步研究。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|