目的: 探讨SOX10对前列腺癌细胞增殖及侵袭能力的影响。方法: 利用Western blotting方法检测SOX10蛋白在前列腺癌细胞系PC3、DU145及LNcap中的表达水平。利用si-RNA干扰的方法下调前列腺癌细胞系PC3及DU145中SOX10的表达,通过细胞增殖及侵袭实验评估SOX10对前列腺癌细胞增殖能力和侵袭能力的影响。结果: 下调SOX10后,前列腺癌细胞的增殖能力明显降低,表现为实验组中前列腺癌细胞PC3及DU145的光密度值明显低于对照组(细胞系PC3: 0 d: 0.166±0.01, 0.162±0.012 vs. 0.155 ±0.01, P>0.05; 1 d: 0.210±0.011, 0.211±0.018 vs. 0.252±0.023, P>0.05; 2 d: 0.293±0.017, 0.280±0.028 vs. 0.433±0.030, P<0.01; 3 d: 0.363±0.071, 0.411±0.038 vs. 0.754±0.045, P<0.01; 4 d: 0.592±0.065, 0.670±0.093 vs. 1.456±0.111, P<0.01。细胞系DU145: 0 d: 0.168±0.018, 0.164±0.01 vs. 0.153 ±0.012, P>0.05; 1 d: 0.218±0.007, 0.206±0.024 vs. 0.255±0.02, P>0.05; 2 d: 0.297±0.013, 0.291±0.012 vs. 0.444±0.023, P<0.05; 3 d: 0.378±0.058, 0.419±0.026 vs. 0.762±0.039, P<0.01; 4 d: 0.681±0.094, 0.618±0.050 vs.1.419±0.170, P<0.01);同时,下调SOX10后前列腺癌细胞的侵袭能力也明显受到抑制,与对照组相比,实验组迁出的细胞数明显减少(细胞系PC3: 142±38, 171±17 vs. 304±55; 细胞系DU145:96±22, 134±23 vs. 341±34), 差异均具有统计学意义( P均<0.05)。结论: SOX10可能通过促进前列腺癌细胞的增殖和侵袭能力促进前列腺癌的发生及进展,并且可能成为前列腺癌潜在的治疗靶点。
Objective: To explore the influence of SOX10 on the proliferation and invasion of prostate cancer cells.Methods: SOX10 protein in prostate cancer cell lines PC3, DU145 and LNcap was detect-ed by Western blotting analysis. The expression of SOX10 in prostate cancer cell lines (PC3 and DU145) were knocked down by small interfering RNAs, and the efficiency of SOX10 by small interfering RNAs was confirmed using Western blotting analysis. CCK-8 assays were conducted to assess the influences of SOX10 on the proliferation of PC3 and DU145 cells, and invasion assays were conducted to assess the influences of SOX10 on the invasion of PC3 and DU145 cells.Results: After SOX10 in prostate cancer cells was knocked down by small interfering RNAs, the proliferation of prostate cancer cells PC3 and DU145 was significantly inhibited. Results of CCK-8 assays showed that the absorbance of PC3 and DU145 in SOX10-silenced groups was decreased compared with those in control groups (PC3: 0 d: 0.166±0.01, 0.162±0.012 vs. 0.155 ±0.01, P>0.05; 1 d: 0.210±0.011, 0.211±0.018 vs 0.252±0.023, P>0.05; 2 d: 0.293±0.017, 0.280±0.028 vs. 0.433±0.030, P<0.01; 3 d: 0.363±0.071, 0.411±0.038 vs. 0.754±0.045, P<0.01; 4 d: 0.592±0.065, 0.670±0.093 vs. 1.456±0.111, P<0.01. DU145: 0 d: 0.168±0.018, 0.164±0.01 vs. 0.153 ±0.012, P>0.05; 1 d: 0.218±0.007, 0.206±0.024 vs. 0.255±0.02, P>0.05; 2 d: 0.297±0.013, 0.291±0.012 vs. 0.444±0.023, P<0.05; 3 d: 0.378±0.058, 0.419±0.026 vs. 0.762±0.039, P<0.01; 4 d: 0.681±0.094, 0.618±0.050 vs. 1.419±0.170, P<0.01). Meanwhile, knocking down SOX10 significantly suppressed the invasion of prostate cancer cells PC3 and DU145. Results of invasion assays showed that the numbers of invaded cells in SOX10-silenced groups were significantly less than those in control groups (PC3: 142±38, 171±17 vs. 304±55; DU145: 96±22, 134±23 vs. 341±34, P<0.05).Conclusions: SOX10 might promote prostate cancer progression by accelerating the ability of the proliferation and invasion of prostate cancer cells, and SOX10 might be a potential therapeutic target for prostate cancer.
近年来, 前列腺癌在全球发病率呈现持续增高的趋势, 严重危害了老年男性的健康[1]。前列腺特异抗原(prostate specific antigen, PSA)筛查以及前列腺穿刺活检对前列腺癌的早期诊断具有重要的意义, 然而, PSA筛查在近年来饱受争议, 前列腺癌穿刺活检也同样具有漏诊的风险[2, 3]。因此, 目前的诊断策略依然需要优化。
随着分子生物学技术的出现和发展, 人们对于肿瘤的研究更加倾向于肿瘤的分子标志物及其发生发展机制, 已经发现多种分子标志物和信号转导途径参与了前列腺癌的发生及进展过程, 这为前列腺癌的诊断和治疗提供了更多的选择。SOX10是转录因子SOX家族中的一个成员, 主要参与神经嵴细胞的分化[4, 5]。但近年来, SOX10被报道在多种肿瘤的发生及发展过程中扮演着重要的角色, 参与了肿瘤细胞的增殖、迁移及侵袭等功能[6], 然而, SOX10对前列腺癌细胞功能影响目前尚不清楚。因此, 本研究通过下调前列腺癌细胞中SOX10的表达进而探索其对前列腺癌细胞增殖及侵袭能力的影响。
前列腺癌PC3、DU145及LNcap细胞(American type culture collection, ATCC)培养于含有10%(体积分数)胎牛血清(Gibco, 美国)及1%(体积分数)双抗(Gibco, 美国)的混合RPMI培养基中, 细胞培养在温度为37 ℃, 体积分数为5% 的CO2培养箱中。
干扰SOX10的小干扰RNA(si-RNA)购买于苏州吉玛基因科技有限公司, 干扰序列(正义序列):si-SOX10-1为5'-GGAAGCCUCACAUCGACUUTT-3', si-SOX10-2为5'-CCGUAUGCAGCACAAGAAATT-3'; 阴性对照序列:si-Ctrl为 5'-UUCUCCGAACGUGUCACGUTT-3'。转染前一天, 将PC3及DU145细胞铺于6孔板中, 铺板密度为50%左右, 铺板后第2天, 按照Lipo3000(Invitrogen, 美国)说明书进行细胞转染。细胞转染24 h后, 收集细胞进行细胞增殖及侵袭实验; 细胞转染48 h后, 利用Western blotting实验对转染效率进行验证。
PC3、DU145及LNcap细胞在培养皿中生长达到80%密度时, 以及PC3和DU145细胞在转染48 h后, 收集细胞沉淀, 加入RIPA(radio immunoprecipitation assay)蛋白裂解液, 冰上裂解20 min, 13 000× g离心15 min后, 收集上清, 利用BCA法测定蛋白浓度。加入蛋白上样缓冲液后, 将蛋白加热到95 ℃进行变性。十二烷基硫酸钠聚丙烯酰氨凝胶电泳(SDS-PAGE), 蛋白上样量为20 μ g, 电泳结束后, 将凝胶上的蛋白转移至硝酸纤维素膜上, 5%(质量分数)脱脂牛奶室温封闭2 h, 加一抗孵育过夜, 第2天用1× TBST洗膜3次, 常温孵育二抗1.5 h后, 1× TBST(triethanolamine buffered saline Tween 20)洗膜3次, 蛋白显影。一抗为兔源SOX10单克隆抗体(体积比1 :1 000稀释, Abcam, 美国), 兔源GADPH单克隆抗体(体积比1 :3 000稀释, CST, 美国); 二抗为山羊抗兔IgG(体积比1 :3 000稀释, 杭州联科生物科技有限公司), GADPH作为内参。
收集转染24 h后的PC3和DU145细胞, 1 000 r/min离心后弃上清, 10%(体积分数)血清的混合RPMI1640培养基重悬细胞, 调整细胞密度为1.5× 104/ mL, 充分混匀, 取100 μ L细胞悬液加到96孔板中, 每组3个复孔。每24 h测量1次细胞在450 nm波长处的光密度, 连续测量5 d。测量前1.5 h将需要测量的孔内培养基更换为含有10% CCK-8溶液的混合培养基100 μ L, 之后在培养箱内孵育 1.5 h。
转染24 h后, 收集PC3及DU145细胞, 1 000 r/min离心后弃上清, 用无血清RPMI1640培养基重悬细胞, 调整细胞密度为1.5× 1
采用SPSS19.0软件进行数据分析, 侵袭的细胞数以均数± 标准差表示, 两组之间的比较采用t检验; 实验组与对照组中CCK-8结果的比较采用双因素方差分析。 P< 0.05认为差异具有统计学意义。
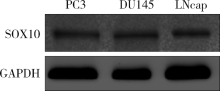
选用PC3、DU145及LNcap 3种前列腺癌细胞系验证SOX10蛋白在其中的表达, Western blotting法发现SOX10蛋白在3种前列腺癌细胞系中都存在表达(图1)。
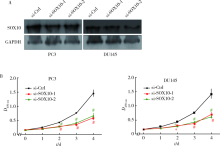
小干扰RNA转染PC3及DU145细胞后, 用Western blotting方法检测小干扰RNA对SOX10的沉默效率, 发现小干扰RNA成功干扰了PC3及DU145细胞中SOX10蛋白的表达(图2A)。
CCK-8结果显示, 实验组中PC3及DU145细胞的光密度明显低于对照组(细胞系PC3: 0 d: 0.166± 0.01, 0.162± 0.012 vs. 0.155 ± 0.01, P> 0.05; 1 d: 0.210± 0.011, 0.211± 0.018 vs. 0.252± 0.023, P> 0.05; 2 d: 0.293± 0.017, 0.280± 0.028 vs. 0.433± 0.030, P< 0.01; 3 d: 0.363± 0.071, 0.411± 0.038 vs. 0.754± 0.045, P< 0.01; 4 d: 0.592± 0.065, 0.670± 0.093 vs. 1.456± 0.111, P< 0.01。细胞系DU145: 0 d: 0.168± 0.018, 0.164± 0.01 vs. 0.153 ± 0.012, P> 0.05; 1 d: 0.218± 0.007, 0.206± 0.024 vs. 0.255± 0.02, P> 0.05; 2 d: 0.297± 0.013, 0.291± 0.012 vs. 0.444± 0.023, P< 0.05; 3 d: 0.378± 0.058, 0.419± 0.026 vs. 0.762± 0.039, P< 0.01; 4 d: 0.681± 0.094, 0.618± 0.050 vs. 1.419± 0.170, P< 0.01, 图2B), 提示下调SOX10能够有效地抑制前列腺癌细胞的增殖能力。
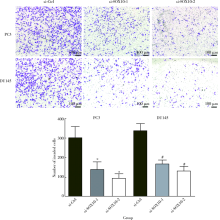
Matrigel侵袭实验结果显示, 实验组中PC3和DU145细胞迁出数分别为(142± 38, 96± 22)和(171± 17, 134± 23), 对照组中PC3和DU145细胞迁出数分别为304± 55和341± 34, 实验组PC3和DU145细胞迁出数明显低于对照组(PC3: t=7.940, P< 0.05; t=5.079, P< 0.05; DU145: t=12.97, P< 0.05; t=14.14, P< 0.05; 图3)。此结果提示, 下调SOX10能够显著地抑制前列腺癌细胞的侵袭能力。
作为转录因子, SOX10主要通过激活并启动靶基因的转录, 从而参与多种细胞分化过程, 特别是神经嵴的发育[7]。人SOX10基因的突变可能导致Waardenburg综合性Ⅱ 、Ⅳ 型 (WS-Ⅱ E, WS-Ⅳ )的发生, 患者主要表现为色素减退、耳蜗感觉神经受损以及肠道神经节细胞缺乏[8, 9, 10]。然而, 越来越多的证据显示, SOX10在多种疾病中出现异常表达的现象, 包括肿瘤[11, 12, 13, 14]。异常表达的SOX10可能参与肿瘤的进展和调控肿瘤细胞的生物学行为[15, 16, 17]。在不同的肿瘤中, SOX10的表达水平及其对细胞功能的影响不同, 如SOX10在肝细胞癌中过度表达并且通过Wnt信号通路增强肝癌细胞的恶性能力, 从而发挥癌基因的作用[14], 然而, SOX10在消化道肿瘤中却扮演抑癌基因的角色, 有趣的是, SOX10也是通过调控Wnt信号通路发挥抑癌作用[18]。
本研究证实SOX10蛋白在3种前列腺癌细胞系PC3、DU145及LNcap中都存在表达, 并且无明显的表达差异, 其中LNcap细胞是雄激素依赖细胞系, 这说明SOX10在前列腺癌中的表达可能与前列腺癌是否发生雄激素抵抗无关, 然而, 这种推测还需要大量的临床研究进行验证。下调SOX10后, 前列腺癌细胞的增殖能力明显减弱, 说明SOX10能够促进前列腺癌细胞的增殖。前列腺癌的发生与多种因素相关, 任何促进前列腺癌细胞增殖的因素都有可能是前列腺癌发生的始因, 也必然能够促进前列腺癌的生长。结合本研究结果, 下调SOX10能够抑制前列腺癌细胞的增殖, 因此, 可以推测, 下调SOX10后, 前列腺癌的生长也将会受到抑制, SOX10可能成为一个抑制前列腺癌细胞增殖的靶点。
肿瘤细胞侵袭能力与肿瘤发生局部浸润和远处转移密切相关[19]。对于前列腺癌而言, 细胞侵袭能力的增加可能增加前列腺癌发生精囊浸润及骨转移的风险, 因此, 抑制前列腺癌细胞的侵袭能力可能减少前列腺癌发生浸润及转移的风险。本研究结果证实, 下调SOX10能够抑制前列腺癌细胞的侵袭能力, 因此, 从理论上讲, SOX10可以作为抑制前列腺癌细胞侵袭的靶点。然而, 本研究只是从细胞生物学水平探索了SOX10对前列腺癌细胞功能的影响, 至于SOX10调控前列腺癌细胞侵袭的分子机制还有待进一步研究。
综上所述, SOX10能够调控前列腺癌细胞的增殖及侵袭能力, 这也是其可能作为靶向治疗靶点的理论基础。但本研究并未对SOX10在前列腺癌组织中的表达水平及其与患者的临床病理特征的关系进行分析, 在以后的研究中, 本课题组将继续探索SOX10在前列腺癌中的表达意义; 同时, 将进一步探索SOX10在前列腺癌发生进展中所介导的信号转导机制以期进一步阐述前列腺癌的发病机制。
(本文编辑:王 蕾)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|