目的: 对遗传性乳光牙本质患者进行临床表型分析,检测基因变异;对患牙的组织形态进行电子显微镜观察,并对其元素含量进行能谱分析。方法: 募集1例遗传性乳光牙本质患者,进行病史采集和临床检查,采集血液样本提取DNA,PCR扩增 DSPP基因编码区并测序,测序结果与数据库比对;收集患牙样本进行组织形态的电子显微镜观察和成分组成的能谱分析,并与正常对照牙齿相比较。结果: 患者有典型的乳光牙本质临床表现,即牙齿变色、磨损、髓腔和根管闭锁等,且伴发釉质发育不全和骨性反牙合表现。在 DSPP基因中发现16个基因变异位点(c.727G>A, c.897A>G, c.2053_2054ins18bp, c.2548G>A, c.2645_2646ins9bp, c.2706T>C, c.2878A>G,c.3004A>G, c.3069_3086del18bp, c.3249A>C, c.3264T>C, c.3266_3400del135bp, c.3418A>G, c.3454G>A, c.3461_3462ins18bp, c.3606C>T), 经分析均为多态性位点,患牙的组织结构和成分组成与对照牙差别明显。扫描电子显微镜下,患牙牙本质小管数目减少,排列稀疏不规则,釉牙本质界失去了典型的扇贝样外形。能谱分析结果为患牙中镁元素含量(0.615 0%±0.261 6%)比对照牙(1.283 3%±0.322 1%)低,差异有统计学意义( P=0.040);患牙中钙元素含量较对照牙高(34.865 0%±0.388 9% vs. 29.221 7%±2.248 4%),差异有统计学意义( P=0.015);患牙钙磷比比值为1.981 2±0.019 3,而对照牙为1.775 9±0.111 6,差异有统计学意义( P=0.049);患牙碳元素和氧元素含量减低、磷元素含量增高,但差异没有统计学意义。结论: 遗传性乳光牙本质的表型分析、基因变异检测和组织学观察结果扩大了该疾病的表型谱,可为进一步的基因和组织学研究提供参考。
Objective: To analyze the clinical characteristics and the genetic cause of a Chinese patient with hereditary opalescent dentin, and to make an observation of the histologic and elemental features of the affected teeth.Methods: We enrolled a patient affected with hereditary opalescent dentin. The medical history was collected and clinical examinations were performed for the phenotypic analyses. The blood sample was collected for DNA extraction and PCRs of the coding sequence of DSPP were done for sanger sequencing. The teeth samples were collected for histological evaluation and elemental analysis.Results: The patient showed typical clinical manifestations of opalescent dentin and had enamel dysplasia and skeletal class Ⅲ malocclusion. Several polymorphisms (c.727G>A, c.897A>G, c.2053_2054ins18bp, c.2548G>A, c.2645_2646ins9bp, c.2706T>C, c.2878A>G,c.3004A>G, c.3069_3086del18bp, c.3249A>C, c.3264T>C, c.3266_3400del135bp, c.3418A>G, c.3454G>A, c.3461_3462ins18bp, c.3606C>T) but no pathogenic mutations were identified in DSPP. The histological analyses of the patient’s teeth showed characteristic abnormalities that were significantly different from normal teeth. The dentin tubules of the affected teeth were decreased in number and sparsed in arrangement, while in the control teeth, they were more regular. The enamel-dentin junction of the affected teeth was abnormal in its less scallopped outline compared with the control teeth under the scanning electronic microscopy. The Mg proportion of the patient’s teeth(0.615 0%±0.261 6%) was lower than that of the control teeth (1.283 3%±0.322 1%), the P value was 0.040. The Ca proportion was the higher compared with the control teeth(34.865 0%±0.388 9% vs. 29.221 7%±2.248 4%), the P value was 0.015. The Ca/P ration of the patient’s teeth was 1.981 2±0.019 3, which was higher than that of control teeth (1.775 9±0.111 6), the P value was 0.049. The differences of Mg, Ca proportion and Ca/P ration between the affected teeth and the control teeth were significant. The C and O proportion of the patient’s teeth were lower and the P proportion was higher compared with the control teeth, however, the differences were not significant.Conclusion: Our study of clinical manifestation analysis, genetic variants sequencing and histological observation has enlarged the phenotypic spectrum of hereditary opalescent dentin, and the genetic and histological results would contribute to further studies.
遗传性乳光牙本质是一种主要累及全口牙牙本质的常染色体显性遗传性疾病, 患病率为1/8 000到1/6 000[1], 远远低于龋病、牙周病这类口腔科常见疾病, 但在口腔专科医院并不罕见。这类患者可出现牙齿蓝色、黄色、琥珀色透光性等颜色改变[2], 严重影响美观; 牙釉质易剥脱导致其下方的牙本质暴露并迅速磨损从而导致面部垂直距离降低[3, 4], 不仅影响美观, 还会影响咀嚼功能; 磨损严重时还可发生根尖病变[4], 但由于患牙的髓腔和根管闭锁, 根管治疗极为困难; 该病属于遗传性疾病, 患者常常对于其子女是否患病比较担忧, 所以这类患者的就诊意愿强烈。
目前的研究认为, 该病的致病基因为牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP)基因[5, 6], 位于第4号染色体, 共有5个外显子和4个内含子。它所编码的蛋白质表达于牙本质和其他组织(如骨、肾、涎腺)中, 但在牙本质中的表达量是其他组织中的数百倍, DSPP蛋白的酶切产物为牙本质涎蛋白(dentin sialoprotein, DSP)和牙本质磷蛋白(dentin phosphoprotein, DPP)[7]。迄今为止, 已在不同的种族中发现DSPP基因40个位点的致病突变, 其中17个位点位于DSP区域[5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20], 23个位点位于DPP区域[2, 14, 21, 22]。
患牙的临床表现特征明显, 组织学方面也有典型改变, 如牙本质小管数目减少、排列稀疏不规则等[3]。传统的研究方法有硬组织磨片、组织切片、电子显微镜、偏光显微镜观察等, 但早期研究成像质量、细节展示效果有限, 随着设备和技术的不断更新和进展, 有必要对乳光牙本质患牙的形态学及组织学进行更深入、更全面的观察研究。
本研究收集到了1例乳光牙本质患者, 并对其进行了临床表现、基因变异和患牙组织结构、元素含量等方面的分析, 以完善并深入对该疾病的认识。
患者为27岁女性, 因牙齿变色、磨耗影响美观及咀嚼功能至北京大学口腔医院修复科就诊, 对患者进行详细的口腔检查, 并评估其全身健康状况。患者父母、姐姐无类似临床表现, 患者否认幼时有四环素类药物服用史, 母亲否认妊娠时期外伤史、感染史、放射线或药物等有害物质接触史, 否认近亲结婚。
本研究获得北京大学口腔医院伦理委员会审查批准(PKUSSIRB-2013011), 研究对象已签署知情同意书。
1.2.1 DNA提取 采集患者及患者姐姐外周血 (4 mL/人), EDTA抗凝, 使用全血DNA提取试剂盒(博迈德, 北京, 中国)按照说明提取DNA, -20℃保存。
1.2.2 PCR扩增 参考以往文献引物序列合成9对引物[2], 使用Taq PCR MasterMix (博迈德, 北京, 中国)对DSPP基因5个外显子及外显子-内含子交界区进行扩增。
1.2.3 测序 PCR产物琼脂糖凝胶电泳鉴定后送擎科新业生物公司(北京, 中国)进行测序。对于DPP区域序列, 使用pClone007载体试剂盒(擎科新业, 北京, 中国)将PCR产物纯化后克隆到pClone007载体再进行测序。使用SEQMAN PRO基因分析软件(DNASTAR, Madison, WI, 美国)进行序列分析。
1.3.1 样本收集 患者两颗下颌第一恒磨牙因缺损严重拔除, 拔除后固定于10%(体积分数)中性甲醛溶液中。正常对照牙为牙冠形态完好、牙釉质及牙本质发育良好、无深层龋坏、髓腔无明显钙化的恒磨牙, 收集到符合条件的对照牙6颗。
1.3.2 扫描电子显微镜观察和能谱分析 患者的36残冠尚存留少量牙釉质, 用30%(体积分数)磷酸酸蚀30 s以去除玷污层, 用于观察断面组织结构; 46残冠无釉质存留, 不做酸蚀处理, 用于能谱分析。6颗正常对照牙分别用金刚砂钻针磨开成两部分, 一部分处理同36, 另一部分处理同46。用蒸馏水冲洗所有样本, 放入烘箱过夜干燥, 于真空干燥箱(BPG-9040A, 上海一恒科学仪器有限公司, 中国)中干燥, 喷金, 扫描电子显微镜(HITACHIS4800, HITACHI, 日本)下观察牙釉质、牙本质及釉牙本质界结构[3]。使用X射线能量色散光谱仪(EMAX, HORIBA, 日本)对牙齿进行元素含量分析, 预实验发现正常牙齿牙本质中能检测到的含量较多的元素种类为钙、磷、碳、氧、镁, 因此对 46 及 6 颗对照牙随机选取的冠部牙本质区域(对照牙避开靠近髓腔的前期牙本质层)分别进行这5种元素的含量(质量百分比)检测, 每个样本的每种元素测试4次, 仪器自动生成平均值作为结果, 并计算钙磷比值[23, 24]。
使用SPSS19.0统计软件进行分析, 采用独立样本t检验比较实验组和对照组结果的差异性, 实验数据以均数± 标准差表示, P< 0.05表示差异有统计学意义。
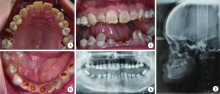
患者为典型的乳光牙本质表现, 全口牙齿呈黄色、琥珀色半透光性变色, 有不同程度的磨损, 前牙最重, 从牙齿断面可见患牙牙釉质极薄, 牙本质呈胶冻状褐色改变(图1 A~C), 上下牙列咬合关系为反牙合, 垂直距离降低。曲面断层片示全口牙牙颈部缩窄呈现“ 球形冠” 外观, 髓腔及根管闭锁, 其中36、46为残冠, 32可见根尖周低密度影像(图1D)。头颅侧位片示上下颌为骨性Ⅲ 类关系(图1E)。患者否认耳聋、骨折史, 否认家族中其他亲属类似病史。因此, 患者符合散发性单纯型遗传性牙本质发育不全Ⅱ 型, 即乳光牙本质的诊断。
经过对患者DNA样本的直接测序和外显子5高度重复片段的单克隆测序, 在外显子4发现了两个SNP位点(c.727G> A, c.897A> G), 在外显子5发现了14个多态性位点(c.2053_2054ins18bp, c.2706T> C, c.2548G> A, c.2645_2646ins9bp, c.2878A> G, c.3004A> G, c.3069_3086del18bp, c.3249A> C, c.3264T> C, c.3266_3400del135bp, c.3418A> G, c.3454G> A, c.3461_3462ins18bp, c.3606C> T), 经《美国医学遗传学与基因组学学院标准指南》分析[25], 这些变异位点均不具有致病性。
2.3.1 电子显微镜下表现(图2) 患牙牙本质断面牙本质小管数目减少, 直径大小不一, 排列稀疏且不规则(图2A、B), 这与正常对照牙直径均一, 排列致密而规则的牙本质小管差异明显(图2E、F)。患牙釉牙本质界仍有凹凸外形, 但波浪较大、不规则, 失去了典型的扇贝样外形(图2C、D), 而正常对照牙齿的釉牙本质界呈现典型的扇贝样外观(图2G、H)。
2.3.2 能谱分析结果 患牙中镁元素含量为0.615 0% ± 0.261 6%, 比对照牙(1.283 3%± 0.322 1%)低, 差异有统计学意义(P=0.040); 患牙钙元素含量较对照牙高(34.865 0%± 0.388 9% vs.29.221 7%± 2.248 4%), 差异有统计学意义(P=0.015); 患牙钙磷比比值为1.981 2± 0.019 3, 而对照牙为1.775 9± 0.111 6, 差异也有统计学意义(P=0.049)。患牙碳元素和氧元素含量减低、磷元素含量增高, 但差异无统计学意义(表1)。
| 表1 患牙和对照牙能谱分析结果( |
遗传性牙本质发育异常可分为牙本质发育不全(dentinogenisis imperfecta, DGI)和牙本质发育不良(dentin dysplasia, DD)两类, 其中牙本质发育不全又可进一步分为3型(DGI-Ⅰ , DGI-Ⅱ , DGI-Ⅲ ), 牙本质发育不良可分为两型(DD-Ⅰ , DD-Ⅱ )[26]。DGI-Ⅱ 又被称为“ 乳光牙本质” , 在这些类型中最为常见。本研究所报道的患者即为典型病例, 全口牙齿为黄色、琥珀色半透光性颜色改变, 前牙切端及少数磨牙有中重度磨损; 曲面断层片表现为球形牙冠, 髓腔和根管闭锁, 且伴有根尖病变。另外, 该患者还有一些新表现, 如从磨损严重的牙齿断面可以看出患牙釉质发育不良, 质地正常但厚度较薄, 以往也有研究报道了1例类似病例[27]。由于DSPP基因除了主要表达于牙本质细胞外, 还在分泌前期的成釉细胞中短暂表达[28], 所以牙本质发育异常与釉质发育不良伴发的这种表现可能是由于DSPP基因的变异影响了釉质的早期发育。除此之外, 本例患者还有上下颌骨性Ⅲ 类错牙合畸形, 即反牙合表现, 这在以往研究中未见描述, 可能是由于DSPP基因在骨中也有少量表达, 所以该基因的变异同时影响了骨的发育, 或者是垂直距离逐渐降低后导致的继发表现, 也可能这两种原因同时起作用。
2001年我国学者首次发现该病致病基因为DSPP基因[5, 6], 随着相关研究的继续深入, 学者们发现DGI-Ⅱ 、DGI-Ⅲ 、DD-Ⅱ 均由该基因的突变引起, 因此认为该3种类型实际上为病情严重程度不一的同一种疾病, 并尝试提出新的分类方法[29]。由于DPP区域大多为由丝氨酸-丝氨酸-天冬氨酸构成的短片段高度重复序列, 无法测序, 因此早期的研究仅局限于DSP区域, 2008年开始DPP区域的成功测序是对该病病因研究的一大突破[2, 14], 但由于测序难度较大, 报道DPP区域变异的研究仍然较少, 且鲜有研究对所收集患者进行基因变异结果的全面展示和分析。本研究对患者DSPP基因的DSP区域和DPP区域分别进行直接测序和单克隆测序后, 共发现16个位点的变异, 其中c.897A> G, c.2706T> C, c.3264T> C和c.3606C> T未造成氨基酸的改变, 为同义性变异; c.727G> A, c.2548G> A, c.2878A> G, c.3004A> G, c.3249A> C, c.3418A> G, c.3454G> A虽然造成了氨基酸的改变, 但这种变异在正常人群中也有较高的出现频率; c.2053_2054ins18bp, c.2645_2646ins9bp, c.3069_3086del18bp, c.3266_3400del135bp, c.3461_3462ins18bp为插入及缺失变异, 但由于位于DSPP序列的高度重复区域, 且改变的碱基数目均为9 bp或9 bp的整数倍数, 因此只会影响氨基酸的重复数目, 实际上, 以上短片段的重复数目在正常人群中也有差异[2]。进一步根据《美国医学遗传学与基因组学学院标准指南》分析[25], 在本患者中检测到的变异都不是致病性变异。这种未能检测到致病突变的情况在其他文献中也有报道[2], 提示本疾病的致病机制较为复杂。本患者的致病原因可能为:(1)除了DSPP基因, 还有尚未发现的其他基因可造成DGI-Ⅱ 的发生, 这可以通过外显子测序等技术进行确认; (2)在本患者中发现的多个多态性位点虽然各自致病性不强, 但同时出现时有可能有强化作用, 这需要通过体外实验及动物实验等进一步验证; (3)拷贝数目变异(copy number variation, CNV)也可能在不同程度上对疾病的发生、发展起到一定作用[30], 但本疾病目前尚未见这方面的研究报道; (4)非编码区变异, 如DSPP基因启动子或者增强子区域出现了变异, 导致转录障碍。本研究尚未涉及这些区域。
与传统光学显微镜相比, 扫描电子显微镜更利于观察物体的微观结构, 在牙体硬组织研究中应用较为广泛[31], 但早期的相关研究受限于设备条件, 成像质量欠佳, 近年来随着技术的进步, 扫描电子显微镜得以展现更丰富、更直观的细节信息, 而且与扫描电子显微镜相连的X射线能量色散光谱仪也为牙齿硬组织的化学成分分析提供了更便利、微创的研究方式, 而无需将牙齿制成粉末。以往的研究显示, 牙本质发育不全患牙牙本质小管数目减少, 直径大小不一, 排列稀疏且不规则[3, 32], 本研究中患牙也有类似表现; 而釉牙本质界的形态则研究结果不一, 一些显示为大致正常的扇贝样结构[33], 而也有研究发现釉牙本质界呈直线状, 失去扇贝样结构, 甚至在釉质和牙本质之间存在较大裂隙[3], 本研究患牙整体上仍可看出波浪样外形但欠规则, 在局部区域失去了典型的扇贝样外形, 较为平坦, 这与患者部分牙齿出现釉质剥脱的现象相符, 提示对乳光牙本质的患者进行临床修复时, 不建议采用贴面等主要依靠釉质粘接固位的修复体, 以防釉质剥脱而造成修复失败。乳光牙本质患牙的能谱分析在国际上鲜有报道, 本例患者患牙的分析结果为镁元素含量降低, 在牙齿发育过程中, 镁与钙互相竞争被吸收参与晶体形成, 镁元素含量降低及钙元素含量增加说明矿化过程中矿物离子的平衡被打破, 进而干扰了最终的矿化。正常情况下前期牙本质中不稳定的无定型磷酸钙含量较多, 所以钙和磷的含量也更加不稳定, 本病例中钙含量明显增高可能也与其矿化异常、钙元素含量不稳定有关。研究发现前期牙本质的钙磷比显著高于矿化牙本质, 所以乳光牙本质中钙磷比增大提示了牙本质的矿化异常[23, 34, 35, 36]。
综上所述, 本研究报道了1例乳光牙本质患者, 表型特征明显, 丰富了该疾病的表型谱; 对患者进行了DSPP基因的突变分析, 除了对DSP区域进行了直接测序, 还对较难扩增的DPP区域成功地完成了克隆测序, 发现若干多态性位点, 提示乳光牙本质病因较为复杂; 患牙的扫描电子显微镜结果及能谱分析结果均与对照牙齿差异明显, 对进一步研究患牙的组织结构特点具有一定的参考价值。
(本文编辑:王 蕾)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|