目的: 评估全腹腔镜下移植输尿管膀胱再植术处理移植肾输尿管狭窄的安全性及有效性,总结腹腔镜下寻找移植肾输尿管的操作经验。方法: 回顾性分析北京大学第三医院泌尿外科2017年11月收治的1例行腹腔镜下移植输尿管膀胱再植术治疗移植肾输尿管狭窄的病例,并复习相关文献。患者女性,54岁,主诉“肾移植术后肾积水5年”入院。查体:移植肾区略膨隆,无压痛。磁共振尿路造影(magnetic resonance urography,MRU)示移植肾及输尿管明显扩张,肾盂扩张最宽处约5 cm,肾盂肾盏均明显扩张,输尿管末段可见狭窄,输尿管内未见异常充盈缺损信号,初步诊断为移植输尿管末段狭窄。既往行两次多镜联合内镜下输尿管狭窄扩张术,拔除支架后移植肾积水无改善。入院后完善术前准备,在全身麻醉下行全腹腔镜下移植输尿管膀胱再植术。首先切断脐正中韧带、脐外侧韧带及腹膜返折,向远端游离膀胱前间隙,逐步游离膀胱左侧壁与耻骨间隙、膀胱前壁与耻骨间隙;其次,膀胱右侧壁游离从头侧至尾侧,仔细辨认周围结构,避免损伤移植肾的输尿管,在膀胱右侧壁与移植肾下极之间寻找移植肾输尿管,剪开输尿管末端,确认切开处近侧输尿管管腔无狭窄,采用Lich-Gregoir法(膀胱外法)行移植肾输尿管膀胱吻合术;最后,将吻合处周围表面膀胱组织与右侧盆壁固定,以减小张力。结果: 手术顺利完成,手术时间210 min,术中出血量约30 mL,无手术并发症。患者术后肌酐稳定,术后第1天肌酐68 μmol/L,较术前下降(术前血清肌酐94 μmol/L), 术后5 d出院。术后随访3个月,KUB(kidney ureter bladder radiography)提示输尿管支架位置良好,拔除输尿管支架后移植肾功能稳定,复查肌酐79 μmol/L,无发热、腰痛等症状,复查移植肾超声示移植肾肾盂略增宽0.7 cm,较前明显改善,移植肾血流正常。结论: 报道采用全腹腔镜移植输尿管膀胱再植术处理肾移植术后输尿管狭窄的病例,该术式是治疗移植肾输尿管狭窄的安全、有效的治疗方法。与开放手术相比,腹腔镜手术对肾移植患者影响更小,具有恢复快、出血少、并发症少,术后疼痛轻,以及伤口微创、美观的优点。该术式手术难度较大,对术者腹腔镜技术要求较高,需要经验丰富的泌尿外科医生操作。
Objective: To discuss the safety and efficacy of laparoscopic ureterovesical reimplantation in the treatment of transplanted ureteral stenosis.Methods: One case of laparoscopic ureterovesicalre implantation in the treatment of ureteral stenosis after renal transplantation was reported, and related literatures was reviewed. A 54-year-old woman was admitted to our hospital with main complaint of hydronephrosis of transplanted kidney for five years after renal transplantation. Her physical examination showed slightly bulging in the transplanted kidney area without tenderness. The magnetic resonance urography (MRU) showed that the transplanted kidney and ureter were dilated obviously, with significant dilatation of renal pelvis and calyx, about 5 cm at the widest point of renal pelvis expansion, and the end of ureter was narrow, without abnormal filling defect in the ureter. The primary diagnosis was distal transplanted ureteral stenosis. After twice endoscopic ureteral dilatation by multi-endoscopic technique, there was no improvement in the hydronephrosis after the removal of the stent.After thorough preoperative preparation, laparoscopic ureterovesical reimplantation was performed under general anesthesia.Firstly, the median umbilical ligament, the lateral umbilical ligament and the peritoneal fold were cut off, and the anterior bladder space was dissociated distally. The space of left side wall of the bladder and the pubic bone was gradually dissociated, and the space of anterior bladder wall and the pubic bone was dissociated. Secondly, the right side wall of the bladder was dissociated from the head to the tail, and the surrounding structure was carefully identified to avoid injury of the ureter of the transplanted kidney.The transplanted ureter was sought between the right side of the bladder and the lower pole of the transplanted kidney. The distal end of the ureter was cut open, and the narrow section was cut off, confirming that no stenosis in the proximal ureter.The ureterocystic anastomosis was performed by Lich-Gregoir method (extra-bladder).Finally, the bladder tissue around the anastomosis site was fixed to the right pelvic wall to reduce tension.Results: The operation was completed successfully, the operation time was 210 min, the amount of bleeding was about 30 mL, and there was no surgical complication. The creatinine was stable after operation, with serum creatinine declining to 68 μmol/L, and serum creatinine 94 μmol/L before operation. The patient was discharged 5 days after operation. After follow-up of 3 months, KUB indicated that the position of ureteral stent was good and the function of renal transplantation was stable.Conclusion: Laparoscopic ureterovesical reimplantation is a safe and effective treatment for ureteral ureteral stricture after renal transplantation. Compared with open surgery, laparoscopic surgery has less impact on renal renal allograft, with faster recovery, less bleeding, fewer complications, less postoperative pain and minimally invasive wound. This surgical procedure is difficult and requires an experienced urologist with high laparoscopic skills to perform.
移植肾输尿管狭窄是肾移植术后最常见的外科并发症之一, 导致移植肾梗阻, 增加移植肾失功的风险。移植肾输尿管狭窄的治疗方式包括内镜下狭窄扩张术、开放或腹腔镜输尿管膀胱再植术、移植输尿管-自体输尿管吻合术、膀胱肌瓣输尿管成型术和肾盂膀胱吻合术等[1]。完全腹腔镜移植输尿管膀胱再植术处理移植肾输尿管狭窄目前国内尚未见报道, 本研究回顾性分析北京大学第三医院2017年11月收治的1例行腹腔镜下移植输尿管膀胱再植术治疗移植肾输尿管狭窄的病例, 探讨腹腔镜下移植输尿管膀胱再植术治疗移植肾输尿管狭窄的安全性及有效性。
回顾性分析北京大学第三医院2017年11月收治的1例行腹腔镜下移植输尿管膀胱再植术治疗移植肾输尿管狭窄的病例, 患者女性, 54岁, 主诉因“ 肾移植术后肾积水5年余” 收入院。患者2012年于外院行右侧同种异体肾移植术, 术后1周患者不慎自行将移植肾输尿管支架拔出。肾移植术后1个月复查移植肾超声示移植肾积水, 肌酐正常, 定期观察随访。2016年5月移植肾积水加重, 肌酐较前略上升, 于外院行多镜联合内镜下移植输尿管狭窄扩张术, 狭窄处位于输尿管末段, 并留置移植输尿管支架1年。其后再次行内镜下狭窄扩张术, 留置输尿管支架1年余。共计留置输尿管支架两年余, 拔除支架后肾积水无改善。患者规律服用抗排异药物, 他克莫司2 mg 每12 h 1次, 吗替麦考酚酯每日早 1 g, 晚0.5 g。规律复查随诊, 血清肌酐正常, 血清肌酐最高95 μ mol/L。为求进一步手术诊疗收住北京大学第三医院。既往患者行胃大部切除术、胆囊切除术、剖宫产术。
查体:身高150 cm, 体重46 kg, 血压 132/88 mmHg(1 mmHg=0.133 kPa), 脉搏 79次/min, 体温36.5 ℃。右下腹可见手术瘢痕约15 cm, 移植肾区略膨隆, 移植肾大小正常, 无压痛, 膀胱区无明显隆起。
入院后血清肌酐94 μ mol/L, 放射性核素肾扫描示:移植肾血流灌注正常, 肾功能尚可, 肾小球滤过率正常(85.24 mL/min); 上尿路引流不畅, 利尿试验提示符合上尿路机械性梗阻积水表现。磁共振尿路造影(magnetic resonance urography, MRU)示移植肾及输尿管明显扩张, 可见移植肾的肾盂肾盏明显扩张积水, 肾盂扩张最宽处约5 cm, 输尿管末段可见狭窄, 输尿管内未见异常充盈缺损信号(图1)。根据患者临床资料, 考虑移植输尿管狭窄部位位于输尿管末段, 既往行两次内镜下扩张术, 均告失败, 遂拟行全腹腔镜下移植输尿管膀胱再植术。
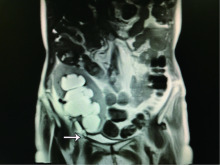 | 图1 术前MRU示:移植肾及输尿管明显扩张, 输尿管末段可见迂曲、狭窄(如箭头所示)Figure 1 Preoperative MRU showed that the transplanted kidney and ureter were obviously dilated, and the distal ureter was tortuous and narrow (arrow) |
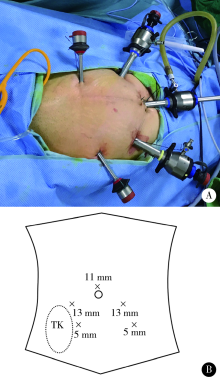
入院后完善术前准备, 在全身麻醉下行全腹腔镜下移植输尿管膀胱再植术。患者仰卧分腿位, 头部降低15° ~30° 。腹腔镜手术Trocar布置如图2, 脐上缘纵行切口2 cm置入11 mm Trocar, 置入30° 腹腔镜镜头, 另于双侧腹直肌外缘脐下3 cm处置入两个13 mm Trocar, 左侧髂前上嵴内侧3 cm处置入一个5 mm Trocar, 右侧髂前上嵴内侧6 cm处置入一个5 mm Trocar。先切断脐正中韧带、脐外侧韧带及腹膜返折, 向远端游离膀胱前间隙, 逐步游离膀胱左侧壁与耻骨间隙、膀胱前壁与耻骨间隙; 膀胱右侧壁游离从头侧至尾侧, 仔细辨认周围结构, 避免损伤移植肾输尿管。游离移植肾下极, 在膀胱镜的辅助下, 在膀胱右侧壁与移植肾下极之间寻找移植肾输尿管, 发现移植肾输尿管周围严重粘连纤维化。于膀胱右侧前壁寻找到移植肾膀胱吻合口, 剪开输尿管末端, 可见尿液流出, 置入F8硅胶尿管, 置入顺利, 引流通畅, 确认切开处近侧输尿管管腔无狭窄, 将膀胱侧剪开的输尿管末段缝扎, 遂行输尿管膀胱吻合术, 吻合方法采用Lich-Gregoir法(膀胱外法)。充分游离膀胱, 减小张力, 便于吻合。将吻合处周围表面膀胱组织与右侧盆壁固定, 以减小张力(图3)。
手术过程顺利, 手术时间210 min, 术中出血量约30 mL。术后第1天患者可进食, 适当下地活动。术后第3天拔除腹腔和盆腔引流管, 切口愈合好。术后肌酐稳定, 肌酐较术前略下降。术前入院血清肌酐94 μ mol/L, 术后第1天血清肌酐68 μ mol/L, 复查KUB(kidney ureter bladder radiography)输尿管支架位置良好, 术后第4天出院。随访3个月, KUB示输尿管支架位置良好(图4)。拔除输尿管支架后无发热, 无移植肾区不适, 化验血常规、电解质、肾功能均正常, 肌酐79 μ mol/L。移植肾超声示移植肾肾盂轻度增宽, 宽约0.7 cm, 较前明显减轻, 移植肾血流正常(图5)。
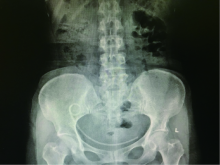 | 图4 术后第3个月KUB示输尿管支架位置良好Figure 4 KUB showed good position of ureteral stent in third months after operation |
肾移植术后外科并发症对移植肾和患者生活质量有严重影响, 主要包括移植肾输尿管尿瘘和输尿管狭窄。肾移植术后输尿管狭窄的发生率为1%~10%[2, 3, 4]。早期(术后1个月内)的移植肾输尿管狭窄比较少见, 发生原因与手术技术密切相关, 如吻合口狭窄、张力过大, 或出现吻合口血肿及淋巴囊肿等手术并发症, 严谨细致的手术操作能够避免绝大多数该类并发症的发生。远期(术后1个月后)输尿管狭窄引起梗阻更为常见[5], 通常由于缺血或排斥反应引起的局部或广泛的纤维化导致。主要原因为取肾或修肾过程中损伤输尿管血液供应及大剂量免疫抑制剂的使用[6, 7], 继发于慢性排斥反应引起输尿管缺血性改变也是原因之一。输尿管的血供来源于输尿管动脉、腹膜后血管和肾动脉, 在取肾过程中, 输尿管动脉和腹膜后血供均被切断, 仅剩肾动脉供血。移植肾输尿管血供来源于肾门并沿输尿管外膜走行, 移植时易受损伤, 因此, 一定要保护好由肾动脉、肾下极和输尿管围成的三角区域内的组织, 以免导致输尿管缺血或坏死。约75%~90%狭窄发生在输尿管远端, 因远端距离肾动脉最远, 所以输尿管膀胱吻合口处狭窄最为常见[2, 8, 9]。
移植肾输尿管发生缺血性损伤时, 由早期的坏死和漏尿, 发展为晚期(术后数月或数年)的输尿管梗阻。移植肾输尿管狭窄危险因素包括供肾动脉数量、移植物功能延迟恢复和供者年龄等[5]。移植物功能延迟恢复导致输尿管坏死的原因可能与输尿管发生水肿, 影响输尿管动脉血供和静脉回流有关, 而异常的静脉回流或静脉血栓也能导致输尿管的坏死[10]。此外, 供肾侧别、移植肾肾门方向不影响输尿管狭窄发生率。输尿管周围纤维化可能与移植肾周感染相关, 研究表明巨细胞感染会增加移植肾输尿管狭窄的风险[11]。为防止移植肾输尿管狭窄, 移植手术时应谨慎操作, 尽可能缩短供肾输尿管长度, 保证血供, 与受者膀胱吻合方法采用Lich-Gregoir法(膀胱外法), 修肾时注意保留肾门和输尿管周围脂肪组织。另外, 注意避免输尿管周围脂肪剥离过多、膀胱肌层隧道包埋过紧、膀胱剥离面过大、精索压迫等。
移植肾为去神经状态, 输尿管狭窄早期没有典型的肾绞痛等梗阻性症状, 多数无症状或偶表现为局部胀痛, 直至移植肾功能不全时才会出现症状[2, 12, 13], 包括尿量减少、无尿、血清肌酐和(或)尿素氮升高及肾盂积水。B超为诊断本病的首选方法, MRU也可发现移植肾积水。MRU可以评估移植肾输尿管梗阻部位、狭窄段长度、移植肾集合系统积水程度。输尿管狭窄的诊断需要与排斥反应鉴别, 或判断是否同时合并排斥反应, 如同时存在, 则应先处理好排斥反应, 再行输尿管狭窄手术治疗。
充分的术前评估及准备是手术成功的安全保障。术前准备包括输尿管狭窄程度的评估、膀胱功能状况的评估、回顾肾移植手术记录情况、一般状况和移植肾功能的评估。首先, 根据He等[8]提出的移植肾输尿管狭窄的分级系统, 北京大学第三医院进行了改进, 常规使用MRU评估输尿管狭窄的部位和长度。输尿管狭窄的严重程度根据血清肌酐、移植肾超声和MRU分为3级:血清肌酐升高、超声检查证实肾盂积水, 但是MRU未见明显狭窄为1级; 血清肌酐升高、超声检查证实肾盂积水, MRU见输尿管膀胱吻合处狭窄段< 1 cm的狭窄为2级; 血清肌酐升高、超声检查证实肾盂积水, 输尿管远端狭窄段> 1 cm者为3级。2级输尿管狭窄建议先行内镜下治疗, 失败或再狭窄后行腹腔镜或开放手术; 3级的输尿管狭窄建议直接行腹腔镜或开放手术[14]。其次, 术前常规完善膀胱镜检查, 观察膀胱是否存在病变影响重建手术, 同时观察移植肾输尿管开口的位置。针对排尿困难患者, 应常规行尿动力学检查, 膀胱尿动力学异常的患者不建议行膀胱肌瓣输尿管成型术, 需要考虑行其他替代治疗。再次, 回顾肾移植手术的情况, 尤其外院完成的肾移植手术, 需要明确供肾侧别、肾门的朝向、血管吻合方式等, 这些信息能够帮助术者判断移植肾和移植输尿管的相对解剖关系。最后, 术前需要稳定患者的一般状况, 完善术前检查, 排除内科相关禁忌证。如果同时存在肾功能不全或排斥反应时, 需要稳定肾功能后, 再行输尿管的重建手术。
在过去输尿管狭窄主要的治疗方式为开放输尿管再植术, 成功率超过90%。随着泌尿外科内镜的发展, 内镜下治疗是移植肾输尿管狭窄的首选治疗方式。其成功率为60%~95%, 复发率约为45%[7, 15]。内镜治疗失败或长段的狭窄, 选择开放、腹腔镜或机器人辅助手术。手术方式包括输尿管膀胱再植术、移植输尿管-自体输尿管吻合术、膀胱肌瓣输尿管成型术和肾盂膀胱吻合术等。全腹腔镜下输尿管膀胱再植术最早于1994年由Ehrlich等[16]报道, 应用于治疗儿童严重的输尿管膀胱反流。Raddy等[17]于1994年报道该术式最早在成人病例的应用。随着腹腔镜和机器人的广泛使用, 腔内吻合技术的快速发展, 腹腔镜或机器人输尿管膀胱再植术取得了满意的长期疗效[18, 19, 20]。
2013年, 西班牙的Gregorio等[21]报道最早的全腹腔镜下输尿管膀胱再植术治疗肾移植术后输尿管狭窄病例, 取得满意的疗效, 成功率为80%, 其术中使用X线行尿路造影辅助寻找输尿管狭窄段。起初担心腹腔内气腹压力造成移植肾功能损害, 但是随着腹腔镜活体供肾手术的开展, 移植肾功能并未受气腹压力影响, 所以, 腹腔镜下输尿管膀胱再植术治疗肾移植术后输尿管狭窄是安全有效的。腹腔镜手术可以到达与开放手术相近的远期疗效, 与开放手术相比, 腹腔镜手术对肾移植患者影响更小, 其具有恢复快、出血少、并发症少, 术后疼痛轻以及伤口微创美观的优点[22, 23, 24, 25]。Packiam等[25]报道了512例接受腹腔镜和开放输尿管再植术的病例, 其中接受腹腔镜手术的300例, 开放手术的212例, 与开放手术相比, 腹腔镜手术的病例总体并发症较低(9% vs.28%), 包括输血(1% vs.11%)、浅表伤口感染(0% vs.5%)和尿路感染(5% vs.11%)。
术式最大的难点在于移植输尿管的辨认, 由于肾移植术后, 移植肾输尿管周围广泛纤维化, 丧失正常的组织层面, 术中需要仔细辨认肾门、髂血管及输尿管的位置。可以术前留置输尿管支架, 以便术中辨认输尿管位置, 但是对于输尿管严重纤维化的患者, 输尿管支架的作用相对局限, 严重粘连、纤维化导致术者难以辨认输尿管支架。术中建议首先尽量广泛游离膀胱, 先针对已知、粘连较轻、层次尚可的部位游离, 再慢慢仔细游离未知、粘连严重、出血风险高的部位。同时建议膀胱镜辅助输尿管位置的辨认, 腹腔镜手术同时行膀胱镜探查, 于膀胱顶壁寻找移植肾输尿管开口, 然后调暗腹腔镜的光源, 膀胱镜前端指示移植肾输尿管开口位置。腹腔镜下于膀胱镜光源指示亮区切开膀胱, 自输尿管末端向头端游离输尿管, 寻找狭窄段, 剪除狭窄段, 输尿管管腔扩张, 可见尿液流出通畅。置入F8硅胶尿管, 无阻力, 置入至肾盂, 尿液引流通畅, 判断解除梗阻。
手术的关键在于保护输尿管使其具有充足的血供, 无张力吻合。行输尿管粘连松解时, 尽量减少对输尿管的热损伤, 降低输尿管血供发生缺血性血管内膜炎的风险。输尿管游离过程中尽量广泛游离膀胱, 而不是过度游离输尿管, 尤其注意对输尿管上段的保护, 避免影响输尿管上段血供。为避免吻合处张力过大, 将吻合口周围膀胱与盆壁组织固定, 降低输尿管膀胱吻合处张力。寻找移植肾输尿管时, 避免误将闭孔血管、性腺血管当作输尿管, 另外也包括髂内血管分出的膀胱上血管。游离肾门处时, 注意保护移植肾血管及髂外血管(图6)。
腹腔镜下的吻合对于术者的要求较高, 要求术者熟练掌握腹腔镜下腹盆腔的解剖位置, 避免重要血管的损伤, 并且需要由具备熟练的腹腔镜下吻合技术的医生操作[21]。此外, 留置输尿管支架位置很重要, 在导丝引导下确保输尿管支架头端进入移植肾肾盂, 膀胱镜直视下确认支架管尾端位于膀胱内。术后常规行KUB检查, 位置良好的输尿管支架降低术后输尿管的再次狭窄发生率[19]。此外, 腹腔镜Trocar的合理布局会方便手术的操作, 提高手术成功率[20]。由于手术难度大, 术后解剖层次不清, 严重粘连纤维化, 要求腹腔镜手术使用高清摄像系统, 保证手术视野清晰, 降低手术风险。常规采用30° 的镜头, 观察视角广, 便于在有限的操作空间下完成高难度的手术。由于机器人手术视野为三维空间, 操作手臂的活动更加灵活, 机器人手术更适合腹腔镜下组织的游离和腔镜下的吻合[26]。
综上所述, 本病例为完全腹腔镜下移植输尿管膀胱再植术治疗移植肾输尿管狭窄的成功病例, 腹腔镜下移植输尿管膀胱吻合术是治疗移植肾输尿管狭窄的安全而有效的治疗术式, 与开放手术相比, 腹腔镜手术对肾移植患者影响更小, 具有恢复快、出血少、并发症少, 术后疼痛轻以及伤口微创、美观的优点, 但该术式难度较大, 对术者腹腔镜技术要求高, 需要经验丰富的泌尿外科医生操作。
(本文编辑:王 蕾)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|