SUMMARY Mucinous tubular and spindle cell carcinoma (MTSCC) is a rare sub-type of renal cell carcinoma (RCC). It has been considered to be a kind of “indolent” tumor with low-grade fashion, weak invasive capacity and relatively favorable prognosis. However, in the current case, a 3.7 cm×2.8 cm spherical mass with contrast enhancement was found in the left kidney incidentally by computed tomography (CT) in a 60-year-old male patient. A lesion in the right humerus (2.1 cm×1.6 cm×3.1 cm) was found at the same time without any symptoms or sign of pathological fracture by magnetic resonance (MR) imaging. Further positron emission tomography (PET)/CT scan which was ordered immediately after admission suggested multiple bone destruction including skull, pelvis, sternum, right humerus and femur, left scapula, multiple vertebrae and libs. Pathological examination after radical nephrectomy and palliative resection with internal fixation of the lesion in the right humerus indicated that both renal (3.0 cm×3.0 cm×2.5 cm) and bone lesions were MTSCC with the features of high-grade ovoid epithelioid cells, cord-like spindle cells and mucinous matrix under light microscope. The diagnosis of renal MTSCC concurrent with multiple bone metastasis was made. This case report suggested the necessity of general evaluation, especially bone scan for possible distant metastasis, as MTSCC might present unexpected advanced behaviors without any orthopedic symptoms. The behavior of bone metastasis might be associated with male and elderly age. MTSCC has similar enhancement features to papillary RCC on CT scan. As results, attentions are needed to differentiate MTSCC from papillary RCC as they both tend to show lesser enhancement degrees than cortex. Rather than exhibiting a dedifferentiating appearance, the pathological characteristics of bone metastasis lesion were close to those of primary renal lesion. The reason of distant metastasis to the bone remained unclear, negative expression of cytokeratin (CK) 7 might be attributed to. Though immunotherapy, chemotherapy and target therapy could all be methods for systematic therapies, procedures to remove renal lesions and prevent skeletal related events are still highly recommended.
黏液性小管和梭形细胞癌(mucinous tubular and spindle cell carcinoma, MTSCC)是肾细胞癌中一种十分罕见的病理亚型。一般认为该亚型的恶性肿瘤具有高分化/低级别、侵袭能力较弱、预后较好等“ 惰性” 肿瘤行为。本例MTSCC展现出了较为特异的临床表现, 现报告如下。
患者, 男, 60岁, 主因“ 体检发现左肾占位” 于2017年12月18日收入北京大学人民医院泌尿外科。患者入院前13天体检行超声检查发现左肾上极占位, 进一步行泌尿系计算机体层摄影(computed tomography, CT)增强扫描, 提示左肾上极低强化肿块影, 3.3 cm× 2.7 cm, 恶性病变不除外, 怀疑为肾乳头癌, 以“ 左肾占位” 收入院。此外, 患者入院前10天曾行CT检查发现右肱骨中下段占位, 怀疑为骨髓瘤。患者既往患高血压病15年, 血压最高180/90 mmHg(1 mmHg=0.133 kPa); 患2型糖尿病10余年, 入院前口服药物后血压、血糖控制可。入院前15年曾出现腔隙性脑梗塞, 入院时口服抗凝药物, 无明显后遗症状。有心绞痛病史, 未行特殊治疗。患者自起病以来, 精神、睡眠、饮食尚可, 大小便正常, 无血尿, 体重未见明显减轻。
入院查体可见患者一般状况尚可。腹部查体未见腹部、腰部、胁肋部膨隆, 未触及明确肿块, 肾区无明显压痛、叩击痛。四肢查体未见右上臂肿胀、畸形, 皮肤无红肿、发热, 未触及肿块, 无压痛, 无骨擦音。
入院后行影像学检查结果:(1)泌尿系增强CT(图1)示双肾大小形态、位置未见异常, 左肾中上部前侧肾实质内见一类圆形等密度灶, 大小约3.7 cm× 2.8 cm, CT值约37 Hu, 增强扫描实质期明显不均匀强化, CT值约46~65 Hu, 延迟期仍可见持续强化, 增强各期强化程度均低于邻近肾实质, 病变边界清晰, 边缘光整, 周围结构未见明显受侵, 左侧肾上腺内侧肢可见一类圆形低密度灶, 大小约 1.3 cm× 0.9 cm, 增强扫描呈中度强化, 扫及范围内可见多发椎体、双侧髂骨类圆形或斑片状低密度影; (2)肱骨磁共振成像(magnetic resonance imaging, MRI)示右侧肱骨中段类椭圆形溶骨性骨质破坏, 内信号不均, 以长T1、稍长T2为主, 主要位于髓腔内, 邻近皮质受累, 抑脂像呈混杂高信号, 增强扫描呈不规则环形强化, 范围约2.1 cm× 1.6 cm× 3.1 cm(前后× 左右× 上下), 周围软组织未见异常强化; (3)肱骨正侧位(X线片)提示右侧肱骨中下段髓腔内椭圆形低密度影, 范围2.6 cm× 1.8 cm, 邻近骨皮质变薄, 周围软组织无明显异常; (4)全身正电子发射计算机断层显像(positron emission tomography, PET)/CT检查提示, 脊柱多个椎体、骨盆、颅骨、胸骨、双侧多条肋骨、右侧肱骨、右侧股骨、左侧肩胛骨可见多发点、片状氟脱氧葡萄糖(fluorodeoxyglucose, FDG)摄取增高灶, 大部分CT可见溶骨性骨质破坏。
结合患者病史、查体及影像学检查结果, 考虑诊断为:左肾占位(肾细胞癌可能性大)、全身多发骨转移、高血压病、2型糖尿病、腔隙性脑梗塞、冠状动脉粥样硬化性心脏病(心绞痛)。患者于2017年12月22日行腹腔镜下根治性肾切除术, 于2018年1月4日行右肱骨肿物刮除植骨内固定术。
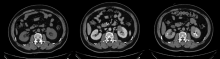 | 图1 MTSCC在泌尿系CT增强扫描中表现(从左至右依次为平扫期、皮髓质期、排泄期)Figure 1 MTSCC in enhanced urinary CT scan (images in plane scanning phase, corticomedullary phase and excretory phases are shown orderly from left to right) |
术后将肾肿物及肱骨肿物标本行病理检查, 结果见图2和图3, 提示:(1)左肾切除标本中可见肿瘤, 由两种成分组成:大部分区域呈腺样及实性巢片状, 细胞卵圆形呈上皮样, 胞浆略嗜酸性, 细胞核中度异型, 其间可见成束及编席状排列的梭形细胞区域, 间质伴有黏液变性, 免疫组织化学染色结果:细胞角蛋白(cytokeratin, CK)(+)、CD10(+)、波形蛋白(vimentin)(+)、碳酸酐酶-9(carbonic anhydrase, CA-Ⅸ )(+)、对成对盒基因(paired box gene, PAX)-8(+)、人黑色素瘤蛋白(human melanoma black, HMB)45(-)、CD31(-), CD34(-)、ETS 相关基因(E26 transformation-specific related gene, ERG)(-)、S-100(-)、肌间线蛋白(desmin)(-)、平滑肌肌动蛋白(smooth muscle actin, SMA)(-)、CK7(-)、雌激素受体(estrogen receptor, ER)(-)、CD117(-)、p504S(+)、孕激素受体(progesterone receptor, PR)(-)、Ki-67(5%~10%), 符合高级别MTSCC, 肿瘤大小3 cm× 3 cm× 2.5 cm。肿瘤侵及肾被膜, 肾门血管及输尿管断端未见癌侵犯。(2)右侧肱骨肿瘤刮除标本:骨组织、纤维组织增生, 可见肿瘤组织, 肿瘤细胞由上皮样细胞及梭形细胞组成, 细胞有异型, 呈腺样及束状排列, 弥漫浸润性生长, 局灶伴有黏液变性, 免疫组织化学染色结果:CK(+)、上皮膜抗原(epithelial membrance antigen, EMA)(+)、CD10(局灶+)、vimentin(+)、PAX-8(+)、PAX-2(局灶+)、p504S(+)、CD34(-)、ERG(局灶+)、前列腺特异抗原(prostate specific antigen, PSA)(-)、GATA-3(-)、CK7(-)、CK20(-)、尾侧型同源转录因子-2(caudal type homeobox transcription factor-2, CDX-2)(-)、甲状腺转录因子-1(thyoid transciiption factor-1, TTF-1)(-)、CD117(-)、S-100(-)、Ki-67(40%+), 符合肾MTSCC骨转移。
MTSCC是肾细胞癌众多病理亚型中的一种, 尽管早在20世纪90年代末即被首次报道, 但因该亚型肿瘤十分罕见(迄今世界范围仅有约100例左右的病例报道), 直到2004年, 世界卫生组织成人肾上皮肿瘤分类目录中才将其定义为一种单独的病理亚型[1]。该型肿瘤多见于女性患者, 患者年龄分布广泛[2, 3]。与大多数肾细胞癌相似, MTSCC患者多无自觉症状, 肿瘤常在患者进行超声、CT、MRI等影像学检查时被偶然发现。在泌尿系CT增强扫描中, 肾病灶可出现缓慢强化, 最大强化多出现在排泄期, 并可出现增强平台期[3]; 在MRI扫描中, 肾病灶在T2相呈现高信号, 在表观弥散系数图(apparent diffusion coefficient, ADC)中呈现低信号[4]。
目前对MTSCC的诊断主要依靠术后病理检查, 在镜下观察病灶的苏木素-伊红(hematoxylin-eosin, HE)染色切片, 可见管状或条索状排列的立方形肿瘤细胞、成束排列的梭形肿瘤细胞, 多为低级别, 同时可见黏液基质[5]。虽然MTSCC的免疫组织化学特征与Ⅰ 型乳头状肾细胞癌有相似之处, 如肿瘤组织中vimentin、CK7、CD10、EMA及AMACR/p504S等分子免疫组织化学染色呈阳性[6], 但由于肾乳头状细胞癌在镜下表现为较明显的乳头形态, 可与MTSCC鉴别。
MTSCC常被认为是一种侵袭能力较弱的“ 惰性肿瘤” , 大多数患者经肾脏手术(肾部分切除术或根治性肾切除术)、射频消融等局部治疗后, 可获得较长的无瘤生存期[3, 7]。但部分患者仍可能出现肿瘤局部复发、淋巴结转移, 包括骨、肺在内的MTSCC远处转移病例也曾被报道。对于局部进展和出现转移的MTSCC, 可采用全身系统治疗。与其他亚型的转移性肾细胞癌相似, 治疗方法包括免疫治疗[血管生成因子酪氨酸激酶抑制剂(tyrosine kinase inhibitors of vascular endothelial growth factor, VEGF-TKI):舒尼替尼、索拉非尼、贝伐单抗, 免疫调节剂:沙利度胺)]、辅助化疗、新辅助化疗(吉西他滨、卡培他滨)[3]。当前并无足够证据证明全身治疗对于转移性MTSCC的疗效, 部分病情进展的患者可能在接受全身系统治疗前即出现全身脏器功能衰竭并死亡[2, 8, 9, 10, 11]。原发肾MTSCC肿瘤细胞低分化(高级别)、肿瘤组织出现肉瘤样变是MTSCC预后不良的因素[5, 12]。
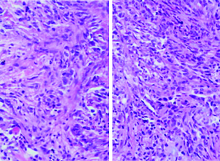 | 图3 MTSCC骨转移病灶病理检查镜下表现(HE × 20)Figure 3 The pathological appearance of MTSCC bone metastasis lesion under light microscopy (HE × 20) |
回顾本病例, 患者为中老年男性, 起病隐匿:仅在体检中行腹部影像学检查时偶然发现一个直径小于4 cm的肾脏占位; 尽管在确诊时患者已经出现包括脊柱多个椎体、骨盆、颅骨、胸骨、双侧多条肋骨、右侧肱骨、右侧股骨、左侧肩胛骨在内的多处溶骨性破坏, 但并无骨痛主诉, 也没有出现病理性骨折、脊髓压迫征等提示骨转移不良预后的临床特征。这与既往报道中MTSCC骨转移与原发病灶出现有一定时间间隔、患者有腰背部疼痛主诉, 甚至出现发热、纳差、恶病质表现等[2, 8, 10]有所差异, 提示MTSCC骨转移也可能表现隐匿, 在临床考虑肾恶性占位或病理证实存在MTSCC时应注意对于全身转移的筛查。此外, 对既往MTSCC骨转移病例的回顾发现, 尽管MTSCC女性多发, 但发生骨转移均为男性患者[8, 10], 且年龄均在45岁以上。这提示性别(男性)、年龄(中老年)可能与MTSCC恶性行为, 特别是骨转移相关。
本例中患者入院前行CT检查曾提示乳头状肾细胞癌可能。回顾患者入院后复查的泌尿系CT增强扫描影像学结果, 可发现本例患者肾脏肿物在增强扫描各期(皮髓质期/实质期、排泄期)均出现强化, 强化过程较为缓慢, 出现了明显的平台期, 且肿物在增强各期强化程度均低于邻近肾实质, 这些都符合MTSCC的影像学特征[13]。而乳头状肾细胞癌也可在CT增强扫描中表现为延迟强化, 且肿瘤强化程度低于正常肾实质[14]; 与此相反, 肾透明细胞癌在CT增强扫描中强化程度普遍高于临近肾实质, 且最大强化一般出现在皮髓质期。由于肾透明细胞癌、乳头状肾细胞癌是肾细胞癌的主要病理亚型, 因而MTSCC的CT表现常易与乳头状肾细胞癌混淆, 提示单纯凭借影像学资料准确诊断MTSCC可能存在困难。
本病例中患者肾脏病灶的病理表现十分典型:可见呈上皮样的卵圆形细胞, 也可见成束及编席状排列的梭形细胞区域和伴有黏液变性的间质成分, 以上特征是最终确定患者原发肾肿瘤为MTSCC的依据。骨转移病灶中, 同样发现了由腺样及束状排列的上皮样细胞、梭形细胞组成的肿瘤细胞和黏液变性成分等MTSCC特征。尽管在原发灶中, 肿瘤表现出了中度异型性, 考虑为高级别MTSCC, 但骨转移灶肿瘤细胞形态基本与肾原发灶相似, 未出现低分化形态, 这可能是患者病情稳定、隐匿, 并未出现骨科相关症状的原因。在进一步的免疫组织化学染色中, 尽管MTSCC病灶中CK7分子多为阳性表达[6], 但本例中肾原发灶和骨转移灶CK7分子均呈阴性。既往对肾MTSCC骨转移的报道中, 也出现过CK7分子的阴性表达, 高度提示该分子可能与MTSCC转移行为, 特别是向骨组织侵袭的行为相关, 但仍有待进一步证实。
在国内临床实践中, 肾MTSCC并不多见, 首次诊断肾肿瘤时即发现全身多发骨转移的情况则更为罕见。结合本文所述, 我们认为:(1)MTSCC起病隐匿, 即使出现全身多发转移, 患者也可能尚未出现晚期肾癌或骨骼相关症状; (2)尽管MTSCC女性多发, 年龄分布广, 但中老年男性患者更有可能出现远处转移(特别是骨转移)等不良肿瘤行为; (3)MTSCC在影像学表现方面也与乳头状肾细胞癌有相似之处, 因此仅依赖影像学诊断MTSCC可能存在难度, 应与术后病理结合分析; (4)MTSCC骨转移灶病理学镜下形态表现与原发灶较为相似, CK7分子的阴性表达可能是其出现恶性远处转移行为的原因; (5)尽管缺乏足够循证依据, 但包括切除原发病肾脏病灶, 对可能出现病理性骨折、脊髓压迫等骨科相关事件的骨转移灶采取内固定、骨水泥充填等预防性治疗在内的手术治疗仍然值得推荐。由于该患者目前刚刚结束手术治疗, 尚未开始进一步全身治疗(如免疫治疗、靶向药物治疗), 对患者最终预后结局的随访将持续进行。
(本文编辑:赵 波)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|



