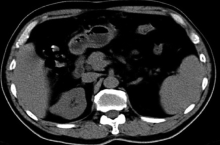
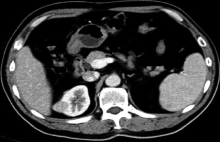
孤立肾合并肾肿瘤的早期发现和治疗在一定程度上提高了患者的生存质量, 随着腹腔镜技术的发展, 腔镜下保留肾单位手术(laparoscopic nephron sparing surgery, LNSS)成为孤立肾合并肾肿瘤的主要术式[1]。本研究回顾分析2015年1月至2017年12月收治的8例孤立肾合并肾肿瘤患者, 行后腹腔镜下肾动脉非阻断法LNSS, 疗效满意, 现报道如下。
本研究8例孤立肾合并肾肿瘤患者均为体检发现, 6例因对侧肾肿瘤行肾切除, 2例为先天性孤立肾; 其中左侧5例, 右侧3例, 男性6例, 女性2例。肿瘤均突出于肾皮质表面, 外上4例, 外中2例, 外下2例。肿瘤平均直径2.8(2~4) cm, 平均年龄49(38~69)岁。术前完善各项常规检查和泌尿系CT平扫(图1)、增强(图2)等, 影像资料均考虑为透明细胞癌T1期。对合并有高血压、糖尿病等疾病者, 围手术期请相关科室会诊予以调整, 排除手术禁忌证。术前详细了解肾动脉走形及其分支, 评估肾功能, 测血肌酐、尿素氮正常范围。
患者行气管插管全身麻醉后, 取健侧卧位, 升高腰桥。常规消毒铺巾后, 常规方法切开皮肤、扩张, 建立后腹膜腔及其操作通道[2], 超声刀清除腹膜外脂肪组织至髂窝, 扩大和整理腹膜后间隙, 显露侧锥筋膜平面, 距离腰肌筋膜1.0 cm纵向切开侧锥筋膜, 长度大致为肾长轴, 肾上极可分离至肾上腺, 先于肾中部肾门水平找到肾后间隙(肾周脂肪囊与后层Gerota筋膜之间的相对无血管间隙, 其内充满白色蜘蛛丝网格状相对无血管疏松结缔组织), 向腰大肌深部游离, 在隆起处分离, 于两层脂肪之间找到肾动脉, 充分游离肾动脉, 并打开肾动脉鞘约0.5~1.0 cm, 备用。同理, 游离肾前间隙至肾上极或肾下极。再于肿瘤部位游离其表面脂肪层, 直至肿瘤完全暴露, 脂肪游离范围为手术剜除及缝合时不妨碍操作为限。
术前设计肿瘤剜除范围及操作的可行性方案, 剜除后创面应有利于左手或右手缝合(因本研究操作者左右手均可熟练使用持针器)。先以肿瘤与肾交界表层距肿瘤边缘0.5 cm剪开一圈肾皮质, 此时出血较少, 可准确标记剜除范围。肿瘤在肾深层的部分以其包膜为界, 使用吸引器与剪刀沿着肿瘤包膜钝性剥离, 吸引器既可保持视野清晰, 又可起到钝性剥离的作用, 在剥离过程中遇到较大纤维条索组织时剪刀离断, 较大血管使用Hem-lock夹闭离断, 直至肿瘤完整剜除, 为减少肿瘤切缘的残留或癌细胞的种植, 术中尽量保留肿瘤包膜的完整性。缝合分两步:第一步:先使用长约20 cm(根据创面深度、宽度定长短)尾端带Hem-lock夹的3-0可吸收线, 按照预设计缝合方案使用左手或右手持针, 于肿瘤窝一侧边缘1 cm进针, 吸引器保持缝合针道视野清晰, 并配合持针器于创面底部“ 8” 字缝合, 在出血最多处用缝合止血方法, 最后从另一创口边缘出针, 用Hem-lock夹线固定。经过第一步缝合, 创面出血已明显减少。第二步:再使用长约20 cm尾端带Hem-lock夹的倒刺线距肿瘤窝创口两侧边缘约1~1.5 cm处连同肾被膜一并全层“ 8” 字缝合, 先缝合创口后收紧缝线, 每一针尾线均使用Hem-lock夹加强固定, 缝合完毕后, 降低气腹压, 检查无活动性出血, 肾色泽良好, 用标本袋将肿瘤取出, 于后腹腔置一根引流管, 逐层关闭皮肤切口, 术毕。
8例患者全部一次性手术成功, 术中平均出血量320(200~800) mL, 肿瘤剜除及缝合平均时间35(25~50) min, 其中3例出血较多, 每例输血800 mL, 无中转开放及阻断肾动脉。术中、术后未出现严重并发症。术后观察无活动性出血, 生命体征及血红蛋白波动正常, 引流量< 200 mL, 尿色正常, 术后4 d内引流量< 20 mL时拔除引流管。术后病理结果均为透明细胞癌。术后平均随访时间16(5~28)个月, 未发现肿瘤复发, 肾功能与术前一致, 术前肌酐(78.0± 4.5)μ mol/L, 术后(80.0± 5.4)μ mol/L, 均在正常范围内, 差异无统计学意义。
根治性肾切除术一直是治疗肾肿瘤的“ 金标准” , 但对解剖性或功能性孤立肾, 根治性肾切除术将会导致肾功能不全或尿毒症[3]。随着腹腔镜技术的进步, LNSS成为微创泌尿外科发展的里程碑[4]。LNSS的近远期效果与开放手术相当, 但其创口小, 恢复快, 已取代传统开放手术, 被认为是小肾癌(T1期)的标准术式[5, 6, 7, 8]。
目前的研究表明肾缺血与肾功能关系密切, 热缺血时间范围20~30 min[9], 但有学者认为热缺血时间< 20 min更安全[10], 由此可见LNSS的缺血时间成为影响肾功能的主要因素, 因此术者尽可能缩短热缺血时间, 从而最大限度保护或者降低肾功能损害。目前减少热缺血的方法有以下几种:(1)采用内置Bull-dog血管夹或外置Satinsky无损伤钳阻断肾蒂血管[11]; (2)降低肾温度法, 包括通过腹腔镜注入冷却液、输尿管逆行灌注冷却液、肾动脉灌注冷却液等[12]; (3)药理学肾脏保护法, 采用甘露醇和呋塞米促利尿[13]; (4)临床最普遍使用的“ 哈巴狗” 肾阻断钳等。
基于上述原因, 以及孤立肾的特殊体质, 为彻底去除热缺血损伤因素, 本研究采用非阻断肾动脉方式行肿瘤剜除, 最大限度去除人为因素导致的肾功能损害, 肿瘤均一期完整剜除。术后随访, 肾功能良好, 未见肿瘤复发, 达到预期治疗效果。非阻断动脉法剜除肿瘤关键在于如何精确定位肿瘤的深度和切除的范围, 如何在有限的时间内完整剜除肿瘤, 对术者的腹腔镜技术, 特别是缝合技术和手术经验具有极高的要求[14], 本研究中因操作者具备良好的腹腔镜操作技能, 故所有手术均一期完成。术中直径 3~4 cm的肿瘤采用两步缝合法, 直径2 cm以下的肿瘤采用第二步全层缝合法。因术中未阻断肾动脉, 减少出血主要依靠手术熟练程度、剜除速度、Hem-lock夹以及第一步快速缝合等方法。如肿瘤直径大于3 cm, 三个戳卡操作慢, 可增加一个戳卡, 助手帮助保持视野清晰, 加快术者的操作速度, 减少出血并缩短关键步骤的操作时间。术中先游离肾动脉很重要, 以防止在操作过程中出血量较大, 严重影响操作进程时快速使用“ 哈巴狗” 肾阻断钳, 从而保证手术顺利完成, 避免造成不必要的出血或肾功能损害。
通过本研究我们认为, 孤立肾合并肾肿瘤在非阻断肾动脉的条件下手术, 对病变位置及术者有一定要求:(1)病变:肾肿瘤应为“ 外向型” , 直径小于4 cm, 位于肾皮质外, 术前肾功能尚好。(2)术者:①熟练掌握腹腔镜下缝合、打结、剜除等技术; ②具备良好的心理素质, 遇到出血沉着冷静, 遇到突发情况及时更改方案, 控制手术节奏, 准确把握手术进程; ③具有良好的解剖思维, 准确定位肿瘤的范围和深度, 在出血状态下以最短的时间完成手术。
虽然本研究样本量少, 但从实践及术后随访分析, 去除了热缺血这一影响肾功能的主要因素, 术后肾功能得到最有效地保护, 手术前后肾功能基本保持一致。术中虽有一定量失血, 部分病例还予以输血, 但相对于热缺血对肾功能的影响, 这种出血和输血是值得的。具体这种手术方式与阻断肾动脉肿瘤剜除对远期肾功能影响有无差异, 尚需大样本前瞻性论证。
就手术方式而言, 通过本研究我们认为, 对孤立肾合并直径< 4 cm且突出于肾皮质的肾肿瘤, 非阻断肾动脉行肿瘤剜除安全可行, 疗效满意。
(本文编辑:刘淑萍)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|