*These authors contributed equally to this work
*These authors contributed equally to this work
肾输尿管全长及膀胱袖状切除术目前被认为是上尿路尿路上皮癌(upper urinary tract urothelial carcinoma, UTUC)的标准治疗术式, 无论采用开放手术还是腹腔镜手术治疗, 均能够实现较好的肿瘤控制效果[1, 2]。国内多采用后腹腔镜处理患侧肾及上段输尿管后, 改平卧位取下腹部弧形切口(Gibson 切口)腹膜外途径处理输尿管末端[3], 但该术式存在一些问题:变换体位增加了手术及麻醉时间; 虽然Gibson切口较大, 但暴露输尿管壁内段仍存在空间受限。本研究采用全腹腔镜下肾输尿管全长切除术治疗UTUC, 利用麦氏点斜切口取出标本, 手术效果良好, 现报告如下。
本研究回顾性分析2016年1月至2017年12月就诊于北京大学人民医院泌尿外科的UTUC患者共78例, 男性43例, 女性35例, 年龄44~75岁, 平均63.5岁。
病例入选标准:经影像学和/或尿液细胞学检查提示UTUC的患者。
病例排除标准:凝血功能障碍、心肺功能衰竭、孤立肾患者, 以及未采用传统术式或全腹腔镜术式的患者。
采用传统术式(经腰后腹腔镜根治性肾切除+Gibson切口膀胱袖状切除)的患者共31例, 采用全腹腔镜术式(全腹腔镜肾输尿管全长切除+麦氏点斜切口取肾)的患者47例, 术前一般资料见表1, 所有患者术前均行泌尿系增强CT检查, 经影像学检查和/或尿液细胞学检查提示UTUC, 其中肿瘤位于肾盂及输尿管上段者64例, 位于输尿管中下段者14例。所有患者术前均详细告知手术风险及获益并签署知情同意书。
| 表1 术前两组患者一般资料比较 Table 1 Comparison of general data between the two groups before operation |
所有患者均采用气管插管、全身麻醉方式。
传统术式:体位采用健侧折刀位, 升高腰桥, 采用“ 球囊扩张法” 建立后腹腔空间[3]。成功建立气腹后, 游离腹膜外脂肪, 打开肾周筋膜, 于腰大肌前方肾门水平打开肾动脉鞘, 游离并用Hemolok结扎肾动脉, 然后于肾下极、腰大肌前方游离输尿管后结扎(不离断), 防止肿瘤随尿液种植, 再离断肾静脉, 最后沿肾周脂肪间隙将肾及肾周脂肪完全游离, 检查创面无明显出血后关闭伤口, 改平卧位, 取Gibson切口, 游离输尿管末端及周围膀胱壁, 完整切除距输尿管末端1 cm的膀胱黏膜, 用可吸收线连续缝合膀胱破口, 留置腹膜后及盆腔引流管各一根, 逐层关闭切口。
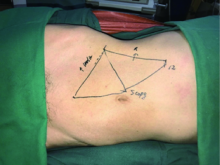
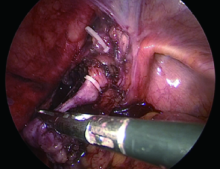
全腹腔镜术式:采用健侧斜仰卧位, 患者腰部位于手术床腰桥正上方, 肩部及臀部分别用支撑托固定, 使身体与水平面呈60° , 固定患者于手术床, 穿刺点分布如图1。首先建立观察孔, 选择脐旁2 cm纵行切口, Hasson切开法建立气腹, 置入30度镜头观察腹腔内情况。第2个穿刺点位于锁骨中线肋弓下, 第3个穿刺点位于腋前线, 距第2个穿刺点约10 cm, 分别置入12 mm Trocar, 总体原则是使3个穿刺点呈等边三角形, 便于处理肾门时的操作。第4个穿刺点位于下腹正中、耻骨联合上约5 cm处, 置入5 mm Trocar, 便于处理末端输尿管以及助手辅助术者暴露肾门等操作。对于肾门血管的处理可参照张树栋等[4]的研究。UTUC的处理不同之处在于输尿管结扎不离断。在完全游离肾脏后沿输尿管向远端游离, 直至手术器械不能探及时, 术者利用第3、4通道进行操作, 监视器置入患侧膝旁, 扶镜手位于术者头侧, 将操作区域转为输尿管下端。提起输尿管下端, 用超声刀将输尿管末端从膀胱壁内段肌层中游离, 显露末端膨大部分, 提起输尿管末端, 用2枚超大号Hemolok夹闭末端输尿管及部分膀胱黏膜, 剪刀锐性离断(图2)。将切开的侧腹膜用可吸收线连续缝合关闭, 将结肠解剖复位固定于侧腹膜上。标本取出切口:标本完全游离后, 从第3个Trocar置入标本袋中, 经麦氏点(左侧经反麦氏点)平行于腹股沟延长切口, 约4~7 cm, 依次切口皮肤、皮下组织, 适当切口牵拉腹外斜肌、腹内斜肌及腹横肌, 切开腹膜, 将标本完全取出, 留置肾窝及盆腔引流管各一根。提起腹膜, 采用PDS Ⅱ (普迪思, 强生可吸收缝线, 美国)连续缝合快速关闭腹膜, 常规关闭切口。
测量两组患者术后切口长度, 传统手术组常规保留尿管2周, 全腹腔镜组尿管保留5~7 d。组织病理诊断为高级别尿路上皮癌的患者, 术后应用吡柔比星行膀胱灌注化疗, 每周1次, 每次40 mg, 连续8次, 然后改为每月1次, 每次40 mg, 连续10次, 术后每3个月行膀胱镜检查。
应用SPSS 19.0软件处理统计数据, 正态分布的连续变量以均数± 标准差表示, 组间比较采用t检验; 非正态分布的计量资料以均数(范围)表示, 组间比较采用Mann-Whitney U非参数检验; 计数资料比较采用χ 2检验, P< 0.05为差异有统计学意义。
78例患者均成功完成手术, 两组均未发生腹腔镜中转开放手术, 无输血及肠道损伤等并发症, 无二次手术及死亡等严重并发症, 两组患者间年龄, 性别, 体重指数(body mass index, BMI), 肿瘤侧别、大小及位置分布比较差异均无统计学意义(P> 0.05, 表1)。
术后组织病理检查, 传统手术组31例为高级别尿路上皮癌, 全腹腔镜组45例为高级别尿路上皮癌, 2例为低度恶性潜能的内翻性乳头状尿路上皮肿瘤。所有患者的组织标本切缘均为阴性。
表2显示, 全腹腔镜组的手术时间、切口长度及术后住院时间均明显短于传统手术组, 两组差异有统计学意义(P< 0.05)。两组之间术中失血量、手术前后肌酐升高水平、并发症发生率及随访时间差异均无统计学意义(P> 0.05)。随访过程中, 术后3个月第1次膀胱镜复查, 传统手术组的输尿管开口及周围膀胱黏膜完全切除, 愈合良好; 全腹腔镜组未见明确患侧输尿管口, 但可见输尿管管口周围膀胱黏膜局部凹陷, 无新生物形成, 未见Hemolok外露。传统手术组1例输尿管中段肿瘤患者在术后8个月时出现膀胱内肿瘤复发, 肿瘤位于膀胱前壁, 行经尿道膀胱肿瘤电切术, 术后组织病理提示高级别尿路上皮癌, 目前仍在密切随访中。
| 表2 两组患者手术相关资料比较 Table 2 Comparison of surgical related data between the two groups |
腹腔镜肾输尿管全长及膀胱袖状切除术在治疗UTUC中的重要作用已被广泛接受[5], 一项前瞻随机对照试验证实, 其肿瘤控制效果至少不差于“ 金标准” — — 开放根治性肾输尿管全长+膀胱袖状切除[6]。随着手术技巧的改进及对疾病认识的不断深入, 腹腔镜手术存在以下几个热点问题需要讨论:(1)肾及上段输尿管的处理:经腹腔途径操作空间大, 解剖关系清晰, 国外学者通常采用此入路方式, 而国内医生通常采用经后腹腔入路, 对腹腔器官干扰小, 术后肠道功能恢复较快[7]。(2)输尿管末端的处理:目前对输尿管末端的处理方式包括膀胱外途径、经膀胱途径、经尿道电切途径、腹腔镜下应用直线切割吻合器途径等[2, 8], 无论采用何种手术途径, “ 无瘤原则” 是各途径必须坚持的原则。(3)切口的设计:经腰切口取标本需要离断大量腰部肌肉和部分神经, 患者术后多有较明显的切口疼痛, 相应区域皮肤感觉减退甚至丧失, 腹壁肌肉张力减低, 发生腹壁膨出或失对称。下腹部正中切口应用较多, 能够有效经膀胱途径处理患侧输尿管口周围黏膜及末端输尿管。下腹部斜切口(Gibson切口):取髂前上棘内侧2.5 cm处做一曲棍球杆样切口, 沿腹股沟皱褶上方2.5 cm至腹直肌外侧缘, 长约7~10 cm, 顺肌纤维方向切开腹外斜肌腱膜, 分开腹内斜肌, 切开腹横肌, 进入腹膜外间隙, 主要用于显露输尿管中下段。在总结前人经验的基础上, 我们通过全腹腔镜完成手术, 并通过麦氏点斜切口取出标本。本研究回顾性分析了采用两种不同术式处理的UTUC患者, 全腹腔镜术式在手术时间上要明显短于传统手术组[(148.4± 32.4) min vs. (191.1± 37.5) min, P=0.001], 在总体并发症及肿瘤复发率两组差异无统计学意义的基础上, 全腹腔镜组术后住院时间明显短于传统手术组[(5.3± 0.9) d vs. (7.1± 1.7) d, P=0.001], 并且下腹部切口长度明显短于传统手术组[(5.4± 1.0) cm vs. (14.5± 1.6) cm, P=0.001]。可以看出, 全腹腔镜术式在实际应用中具有极大优势:(1)一体位完成手术, 缩短手术时间; (2)离断肌肉少, 切口伸缩性好, 易于将标本取出, 缝合方便, 术后恢复快(图3)。
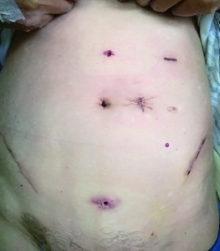 | 图3 左侧麦氏点斜切口与右侧原阑尾切口对比Figure 3 The left McBurney oblique incision compared with the right previous appendiceal incision |
在实际手术过程中, 全腹腔镜术式继承了既往手术的优势, 又兼顾了术后患者的切口美观, 我们总结47例患者的治疗经验如下:(1)经腹腹腔镜的优势:首先, 在体位上, 后腹腔镜对腰桥的高度比较严格, 充分的升高腰桥才能将腰部间隙打开, 为腹腔镜操作创造空间, 但经腹腹腔镜并不需要过多的升高腰桥, 对于腰椎有手术史或活动受限的患者, 甚至可以保持腰桥于水平位置; 其次, 经腹腔入路操作空间大, 解剖标志清楚, 尤其对于既往有输尿管镜检病史或肾积水、肾门淋巴粘连的患者, 肾门动、静脉分离过程中容易出血, 导致视野不清, 此时采用直线切割闭合器能够安全、有效地对肾门动、静脉进行结扎离断, 缩短手术时间, 减少术中出血。(2)一体位手术:经腹入路处理上尿路肿瘤的方式已被国内众多学者所熟悉[9, 10], 我们在手术Trocar布局上, 采用“ 上下兼顾” 的原则, 不额外增加操作通道(右侧肿瘤需增加一5 mm Trocar挑肝通道), 在处理下段输尿管时, 将镜头从头侧向足侧观察, 此时, 术者的操作通道应与观察通道呈三角对称关系, 新增下腹部5 mm Trocar便于术者操作(图1)。(3)麦氏点斜切口的优势(图2):采用略高于髂脊上方Trocar穿刺点切口开始, 平行于腹股沟上方约2 cm, 根据标本大小决定切口长度, 一般约4~6 cm, 一些既往同侧有阑尾手术病史的患者亦可沿原阑尾切口取出标本, 此切口无腰腹壁神经损伤, 只需离断少量腹壁肌肉, 切口伸缩性好, 便于手术标本取出, 直视下能快速关闭腹膜, 缩短手术时间。切口并发症(如切口疝、腹壁膨出、脂肪液化、切口愈合不良、腹部不对称等)大大减少。切口容易被衣物遮盖, 美容度高。(4)无瘤原则贯穿于整个术中:通常我们在游离结扎肾动脉后, 紧接着寻找输尿管, 将输尿管上段用Hemolok闭合, 最大程度避免处理肾脏过程中的尿液下流, 在处理输尿管末端时, 充分将输尿管末端膨隆处牵拉暴露, 再用12 mm Hemolok结扎后离断(图3), 完全在封闭状态下处理标本, 避免尿液外渗。有研究也报道了用直线切割闭合器处理输尿管末端, 但闭合钉暴露于膀胱黏膜下有形成膀胱结石的可能, 并且远端切缘无法进行良好的切缘组织学评价[11]。我们采用12 mm的Hemolok结扎, 不用担心因闭合钉暴露于膀胱内导致的膀胱结石问题, 并且保证了切缘阴性。
本研究共回顾性分析了78例患者, 所有手术均顺利完成, 未发生严重并发症, 与传统手术方式相比, 全腹腔镜组在手术时间、切口长度及术后住院时间方面均有明显优势。但是因为本研究为回顾性研究, 具有一定的局限性, 另外, 不建议应用于输尿管多发肿瘤, 包括远端输尿管及壁内段肿瘤的患者, 以最大程度避免切缘阳性。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|