目的: 探讨二甲双胍对子宫内膜癌细胞脂联素受体的作用及联合使用二甲双胍和脂联素对子宫内膜癌细胞增殖的影响。方法: 用CCK-8法检测不同浓度二甲双胍和脂联素对IK(ishikawa)和HEC-1B两种子宫内膜癌细胞系增殖的影响。用实时荧光定量RT-PCR(quantitative real time RT-PCR, qRT-PCR)法和Western blot法检测不同浓度二甲双胍作用下IK和HEC-1B细胞脂联素受体[包括脂联素受体1(adiponectin receptor 1,AdipoR1)和脂联素受体2(adiponectin receptor 2,AdipoR2)]的变化及磷酸腺苷活化的蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)通路抑制剂compound C对以上作用的影响。结果: (1)二甲双胍和脂联素均可抑制IK和HEC-1B细胞的生长增殖,并且都呈时间和浓度依赖性( P<0.05);(2)二甲双胍和脂联素对IK和HEC-1B细胞有协同抑制增殖作用,IK细胞药物联合指数(combination index,CI)为0.906 34,HEC-1B细胞CI为0.827 65;(3)用5 mmol/L和10 mmol/L的二甲双胍分别刺激IK和HEC-1B细胞48 h,细胞AdipoR1和AdipoR2 mRNA的水平较对照组(0 mmol/L)显著增高(IK:AdipoR1:5 mmol/L和10 mmol/L组 P均<0.001,AdipoR2:5 mmol/L组 P<0.001;HEC-1B:AdipoR1:5 mmol/L组 P<0.001,10 mmol/L组 P=0.023,AdipoR2:5 mmol/L组 P<0.001,10 mmol/L组 P=0.024), 联合compound C时,该作用被抑制,与对照组(0 mmol/L)相比AdipoR1和AdipoR2 mRNA水平差异无统计学意义( P>0.05);(4)用5 mmol/L和10 mmol/L的二甲双胍分别刺激IK和HEC-1B细胞48 h,细胞AdipoR1和AdipoR2的蛋白水平较对照组(0 mmol/L)显著增高(IK:AdipoR1:5 mmol/L组 P=0.04,10 mmol/L组 P=0.033;AdipoR2:5 mmol/L组 P=0.044,10 mmol/L组 P=0.046。HEC-1B:AdipoR1:5 mmol/L组 P=0.04,10 mmol/L组 P=0.049;AdipoR2:5 mmol/L组 P=0.043,10 mmol/L 组 P=0.035), 联合compound C时,该作用被抑制,与对照组(0 mmol/L)相比,AdipoR1和AdipoR2蛋白表达差异无统计学意义( P>0.05)。结论: 二甲双胍和脂联素具有协同抑制子宫内膜癌细胞IK和HEC-1B增殖的作用,二甲双胍可上调子宫内膜癌细胞脂联素受体的表达,AMPK通路参与这一过程。
* These authors contributed to the work equally
Objective: To determine the effect of metformin and adiponectin on the proliferation of EC cells and the relationship between metformin and adiponectin.Methods: The proliferation impact of different concentrations of metformin and adiponectin on two types of EC cells ishikawa (IK) and HEC-1B was confirmed by CCK-8 method. qRT-PCR and Western blot were used to detect the effect of different concentrations of metformin on the changes of adiponectin receptors (AdipoR1 and AdipoR2) of the EC cells both in mRNA and protein level and the role of compound C, an adenosine monophosphate-activated protein kinase (AMPK) inhibitor, on the above effects.Results: (1) Both metformin and adiponectin could significantly promote the proliferation of endometrial cancer (EC) cells in a time and concentration dependent manner ( P<0.05).(2)Metformin and adiponectin had synergy anti-proliferative effect on EC cells and the combination index (CI) value of IK cells was 0.906 34 and of HEC-1B cells was 0.827 65.(3)qRT-PCR was used to detect the mRNA levels of AdipoR1 and AdipoR2 after 5 mmol/L and 10 mmol/L metformin, respectively, stimulating IK and HEC-1B cells for 48 hours and the mRNA expressions of AdipoR1 and AdipoR2 were significantly increased when compared with the control group (0 mmol/L)(IK: AdipoR1 of 5 mmol/L and 10 mmol/L group: P<0.001,AdipoR2 of 5 mmol/L group: P<0.001; HEC-1B: AdipoR1 of 5 mmol/L group: P<0.001, 10 mmol/L group: P=0.023, AdipoR2 of 5 mmol/L group: P<0.001, 10 mmol/L group: P=0.024). When combined with compound C, the RNA levels of AdipoR1 and AdipoR2 were not different compared with the control group (0 mmol/L, P>0.05). (4) Western blot was used to detect the protein levels of AdipoR1 and AdipoR2 after 5 mmol/L and 10 mmol/L metformin, stimulating IK and HEC-1B cells for 48 hours and the protein level was significantly increased when compared with the control group (0 mmol/L)(IK: AdipoR1 of 5 mmol/L group: P=0.04, 10 mmol/L group: P=0.033, AdipoR2 of 5 mmol/L group: P=0.044, 10 mmol/L group: P=0.046; HEC-1B: AdipoR1 of 5 mmol/L group: P=0.04, 10 mmol/L group: P=0.049, AdipoR2 of 5 mmol/L group: P=0.043, 10 mmol/L group: P=0.035). When combined with compound C,the protein levels of AdipoR1 and AdipoR2 were not different compared with the control group (0 mmol/L, P>0.05).Conclusion: We find that metformin and adiponectin have synergy anti-proliferative effect on EC cells. Besides, metformin can increase adiponectin receptors expressions of EC cells both in mRNA and protein levels and this effect is accomplished by the activation of AMPK signaling pathway.
子宫内膜癌是女性生殖道最常见的恶性肿瘤之一, 好发于围绝经期和绝经后女性。近年来, 随着人们生活水平的提高和饮食结构的改变, 我国子宫内膜癌的发病率和死亡率逐年增加[1]。流行病学调查显示, 2型糖尿病(type 2 diabetes, T2DM)、多囊卵巢综合征及腹型肥胖等代谢性疾病是子宫内膜癌发病的高危因素[2], 其中肥胖和T2DM与子宫内膜癌的关系尤为密切[3]。有研究发现, 体重指数(body mass index, BMI)每增加5 kg/m2, 子宫内膜癌的发病相对风险增加1.59倍[4]。脂肪组织作为体内最大的内分泌器官, 可分泌多种脂肪因子。脂联素是1995年发现的一种脂肪因子, 一项荟萃分析发现, 子宫内膜癌患者体内的脂联素水平明显降低, 低水平的脂联素是内膜癌发病的独立危险因素[5]。研究表明, 脂联素主要通过与AdipoR1和AdipoR2结合发挥作用, AdipoR1和AdipoR2在内膜癌组织中较正常子宫内膜组织表达降低, 脂联素与受体结合后激活磷酸腺苷活化的蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)通路, 抑制哺乳类雷帕霉素靶蛋白(mammalian target of rapa-mycin, mTOR)/磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase, PI3K)/蛋白激酶B通路, 从而抑制子宫内膜癌细胞增殖, 介导细胞凋亡[6, 7]。
近年来研究发现, 二甲双胍对子宫内膜癌的发生发展有保护作用[8], 二甲双胍进入机体后, 可降低循环中胰岛素及胰岛素生长因子1的水平, 同时降低机体增殖细胞相关的核抗原ki-67的表达[9]。二甲双胍转运入细胞后主要通过激活AMPK通路, 抑制下游PI3K/Akt/mTOR通路发挥抑制内膜癌细胞生长增殖的作用[10]。脂联素和二甲双胍均可缓解体内胰岛素抵抗, 并且通过AMPK通路抑制内膜癌细胞的生长增殖, 但二者之间的相互作用关系目前尚不清楚。本研究通过不同浓度的二甲双胍联合或不联合脂联素刺激子宫内膜癌细胞来探讨二者联合作用对内膜癌细胞增殖的影响及二甲双胍对细胞脂联素受体的作用。
0.25%(质量分数)胰酶(Trypsin-EDTA)购自美国Thermo Fisher公司, 胎牛血清购自美国Hyclone公司, DMEM/F12培养基购自美国Hyclone公司, CCK-8试剂盒购自日本同仁化学研究所, Trizol购自美国Invitrogen公司, 逆转录试剂盒 High-Capacity cDNA Reverse Transcription Kit购自美国Applied Biosystems公司, SYBR Green Mix酶购自美国Applied Biosystems公司, 二甲双胍和AMPK通路抑制剂compound C购自美国Sigma公司, 细胞裂解液购自中杉金桥生物技术有限公司, 脂联素购自美国R& D公司, 鼠抗人Tubulin单克隆抗体、兔抗人AdipoR1单克隆抗体和兔抗人AdipoR2单克隆抗体均购自英国Abcam公司。
人子宫内膜癌细胞系ishikawa(IK, 高分化)和HEC-1B(中分化), 均由北京大学第一医院妇产科实验室保存。
1.3.1 细胞培养
采用含10%(体积分数)胎牛血清和1%(体积分数)双抗的DMEM/F12培养基培养IK和HEC-1B细胞, 细胞置于37 ℃5%(体积分数)CO2的细胞培养箱中, 细胞系常规2~3 d传代。
1.3.2 CCK-8法检测不同浓度二甲双胍和脂联素对细胞增殖的影响
IK和HEC-1B细胞分别以8× 103/孔和1× 104/孔接种于96孔板, 待细胞贴壁。在无血清的DMEM/F12培养基中培养24 h后, 用不同浓度的二甲双胍(0.5、1、5和10 mmol/L, 以0 mmol/L作为空白对照)和脂联素[0.1、1、5和10 mg/L (μ g/mL), 以0 mg/L作为空白对照]刺激IK和HEC-1B细胞, 分别作用24、48和72 h, 测定450 nm波长处的光密度, 检测细胞增殖的变化。用不同浓度的二甲双胍(1、2.5和5 mmol/L)联合脂联素(1、2.5和5 mg/L)刺激IK和HEC-1B细胞48 h, 检测细胞增殖的变化。
1.3.3 检测不同浓度二甲双胍及compound C作用下细胞脂联素受体的变化
IK和HEC-1B细胞分别以8× 105/孔和1× 106/孔的浓度接种于6孔板, 贴壁生长后分为二甲双胍组(0、5和10 mmol/L)和二甲双胍(5和10 mmol/L)联合compound C组共5组, 刺激48 h后, 分别提取细胞RNA和总蛋白, 用qRT-PCR法和Western blot法检测脂联素受体的变化。
1.3.3.1 qRT-PCR法 按照Trizol说明书提取各组细胞RNA, 按照High-Capacity cDNA Reverse Transcription Kit试剂盒说明书将RNA反转录为cDNA, 在ABI 7500仪器(LifeTech, Applied Biosystems)进行RT-PCR。RT-PCR体系:SYBR Select Master Mix(10 μ L)+cDNA(1 μ L)+DEPC水(5 μ L)+上游引物(2 μ L)+下游引物(2 μ L)。引物设计使用PrimerPremier 6.0软件, 由上海生物工程股份有限公司合成, 序列见表1。
| 表1 引物序列 Table 1 The primer sequence |
1.3.3.2 Western blot法 用细胞裂解液提取细胞全蛋白。应用Bio-Rad 蛋白定量试剂盒, 进行蛋白定量。以每孔40 μ g蛋白量上样, 80 V恒压电泳, 约20~30 min, 120 V恒压电泳约1.5 h。冰水浴下200 mA恒流转膜2.5 h, 5%(质量分数)牛奶室温封闭1 h。一抗(鼠抗人Tubulin单克隆抗体、兔抗人AdipoR1单克隆抗体和兔抗人AdipoR2单克隆抗体)4 ℃孵育过夜, 充分洗涤后, 二抗(山羊抗兔/鼠抗体)室温摇床孵育1 h。充分洗涤后发光、显影、曝光。Western blot 的扫描结果用Image J分析灰度软件分析。以上实验重复3次。
数据分析用SPSS13.0软件, 计量资料以均数± 标准差表示。两组间的比较用独立样本t检验, 两组以上的组间比较用单因素方差分析, P< 0.05认为差异有统计学意义。
2.1.1 二甲双胍能够抑制子宫内膜癌细胞系IK和HEC-1B的生长增殖, 且成时间和浓度依赖性
(1)用不同浓度的二甲双胍刺激IK和HEC-1B细胞后, 与对照组(0 mmol/L)相比, 均有显著的抑制细胞增殖的效应(P< 0.05), 且二甲双胍浓度越高, 抑制增殖的作用越明显; (2)在1、5和10 mmol/L组, 二甲双胍作用时间越长, 抑制细胞增殖作用越明显(P< 0.05, 表2、3)。
| 表2 不同浓度二甲双胍对IK细胞增殖的影响( |
| 表3 不同浓度二甲双胍对HEC-1B细胞增殖的影响( |
2.1.2 脂联素能够抑制子宫内膜癌细胞系IK和HEC-1B的生长增殖, 且成时间和浓度依赖性
(1)用不同浓度的脂联素刺激IK和HEC-1B细胞后, 与对照组(0 mmol/L)相比, 均有显著的抑制细胞增殖效应(P< 0.05), 且脂联素浓度越高, 抑制增殖的作用越明显(P< 0.05); (2)在1、5和10 mg/L组, 脂联素作用时间越长, 抑制细胞增殖作用越明显(P< 0.05, 表4、5)。
| 表4 不同浓度脂联素对IK细胞增殖的影响( |
| 表5 不同浓度脂联素对HEC-1B细胞增殖的影响( |
2.1.3 二甲双胍和脂联素对于子宫内膜癌细胞系IK和HEC-1B具有协同抗增殖作用
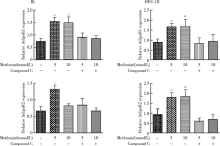
用1、2.5和5 mmol/L的二甲双胍联合或不联合脂联素分别刺激IK和HEC-1B细胞48 h, CCK-8法检测发现, 联合使用二甲双胍和compound C时, 二甲双胍抑制IK和HEC-1B细胞增殖的作用被减弱; 联合使用二甲双胍和脂联素时, 对子宫内膜癌细胞系的抑制作用显著强于单独使用二甲双胍时(P< 0.05)。IK细胞联合指数(combination index, CI)为0.906 34, HEC-1B细胞CI为0.827 65(图1)。
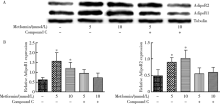
用5 mmol/L的二甲双胍刺激IK细胞48 h, 与对照组(0 mmol/L)相比, 细胞AdipoR1和AdipoR2的mRNA表达增加(P< 0.001); 用10 mmol/L的二甲双胍刺激IK细胞时, AdipoR1表达增加(P< 0.001), AdipoR2表达有增高趋势, 但差异无统计学意义。用5 mmol/L和10 mmol/L的二甲双胍刺激HEC-1B细胞48 h, 与对照组(0 mmol/L)相比, 细胞AdipoR1和AdipoR2的mRNA表达增加(AdipoR1:5 mmol/L组P< 0.001, 10 mmol/L组P=0.023, AdipoR2:5 mmol/L组P< 0.001, 10 mmol/L组P=0.024)。当联合compound C时, 细胞AdipoR1和AdipoR2的mRNA水平降低, 但与对照组(0 mmol/L)相比差异无统计学意义(图2)。
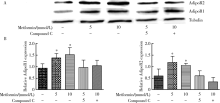
用5和10 mmol/L的二甲双胍刺激IK和HEC-1B细胞48 h, 与对照组(0 mmol/L)相比, 细胞AdipoR1和AdipoR2的蛋白表达增加(IK:AdipoR1:5 mmol/L组P=0.040, 10 mmol/L组P=0.033; AdipoR2:5 mmol/L组P=0.044, 10 mmol/L组P=0.046; HEC-1B:AdipoR1:5 mmol/L组P=0.04, 10 mmol/L组P=0.049; AdipoR2:5 mmol/L组P=0.043, 10 mmol/L组P=0.035); 当联合compound C时, 细胞AdipoR1和AdipoR2的蛋白水平降低, 与对照组(0 mmol/L)相比, 差异无统计学意义(图3、4)。
本研究证实了二甲双胍能够协同增强脂联素抑制子宫内膜癌细胞增殖的作用, 能够促进IK和HEC-1B细胞AdipoR1和AdipoR2的表达。AMPK通路抑制剂compound C可抑制二甲双胍上调AdipoR1和AdipoR2表达的作用, 说明AMPK通路可能参与这一过程。
子宫内膜癌的发生发展与遗传、环境、医疗和生活方式等多种因素有关。目前一致认为, 长期低水平的无孕激素拮抗的雌激素刺激是导致子宫内膜增生和癌变的主要因素[11]。此外, 研究表明代谢综合征是子宫内膜癌发病的高危因素, 胰岛素抵抗和高胰岛素血症是其发病的共同病理生理基础。当机体出现胰岛素抵抗和高胰岛素血症时, 循环中的高水平胰岛素可增强雌激素活性, 二者联合刺激极大地促进了子宫内膜细胞的增殖, 提高了子宫内膜癌的发病风险[12]。研究表明, 代谢修复剂二甲双胍一方面可降低循环中胰岛素水平, 缓解胰岛素抵抗, 调节机体代谢紊乱; 另一方面可通过激活AMPK通路, 抑制PI3K/Akt/mTOR通路, 抑制子宫内膜癌细胞的生长增殖, 介导细胞凋亡[13]。本课题组前期研究已证实[14], 二甲双胍可活化子宫内膜癌细胞中AMPK, 抑制下游PI3K/Akt/mTOR通路, 抑制内膜癌细胞增殖, 同时上调内膜癌细胞孕激素受体的表达, 协同增强醋酸甲强孕酮对内膜癌细胞的增殖抑制作用。本研究通过CCK-8法检测了不同浓度二甲双胍对IK和HEC-1B两种子宫内膜癌细胞系增殖作用的影响, 证实了二甲双胍可抑制子宫内膜癌细胞的生长增殖, 并有时间依赖性和浓度依赖性。
肥胖是子宫内膜癌发病的独立危险因素, 在肥胖患者体内, 脂联素编码基因adipoQ发生调节异常, 循环中脂联素水平明显降低, 低水平的脂联素是子宫内膜癌发病的独立危险因素。体外研究发现, 脂联素可通过与子宫内膜癌细胞AdipoR1和AdipoR2结合, 激活AMPK通路, 发挥抑制细胞增殖, 介导细胞凋亡的作用[6]。本研究采用不同浓度的脂联素作用于IK和HEC-1B细胞, 通过CCK-8法证实了脂联素可抑制子宫内膜癌细胞的生长增殖, 并有时间依赖性和浓度依赖性。
二甲双胍和脂联素均可通过缓解机体胰岛素抵抗和高胰岛素血症, 调节机体代谢紊乱。对于伴肥胖的T2DM患者, 使用二甲双胍可降低其BMI, 同时二甲双胍可上调肥胖患者体内脂联素基因的表达, 促进脂肪组织分泌脂联素[15]。二甲双胍和脂联素均可通过激活AMPK通路发挥对内膜癌细胞的抑制增殖作用, 同时二甲双胍可上调代谢紊乱患者体内的脂联素水平, 那么二甲双胍是否可以调节子宫内膜癌细胞脂联素及其受体的表达, 二甲双胍与脂联素联合对子宫内膜癌细胞又有什么作用, 目前关于二者相互作用的机制尚缺乏研究。本研究通过CCK-8法发现二甲双胍与脂联素对于子宫内膜癌细胞具有协同抗增殖作用。此外, 本研究还发现二甲双胍可以上调子宫内膜癌细胞AdipoR1和AdipoR2的表达, 并从mRNA水平和蛋白水平进一步验证了该结论。当联合使用AMPK通路抑制剂compound C时, 二甲双胍促进AdipoR1和AdipoR2表达的作用被抑制, 提示AMPK通路可能参与这一过程。本研究认为二甲双胍可能增强脂联素对子宫内膜癌细胞的增殖抑制作用。二甲双胍浓度高于正常的血药浓度是本研究的不足之处, 因此下一步实验本课题组考虑延长二甲双胍的作用时间, 在保证其抑制子宫内膜癌细胞生长增殖、上调细胞AdipoR1和AdipoR2表达的前提下, 降低二甲双胍浓度, 使其具有临床实用价值。
二甲双胍作为降糖药, 已经在临床上广泛应用50余年, 其不良反应主要是胃肠道反应, 患者的耐受性较好可长期使用。研究表明, 子宫内膜癌患者术前窗口期使用二甲双胍可降低机体增殖细胞相关的核抗原ki-67的表达, 同时缓解机体胰岛素抵抗, 抑制癌细胞的增殖, 可能对子宫内膜癌的发展起一定保护作用[16]。此外, 二甲双胍可提高子宫内膜癌细胞对化疗药物紫杉醇的敏感性, 可能在保证化疗效果的前提下, 降低化疗药物剂量, 减少化疗药物对患者的毒副作用[17]。因此, 二甲双胍作为一种新型的抗肿瘤药物, 具有广泛前景, 它有望成为预防和治疗子宫内膜癌的辅助用药。代谢综合征是子宫内膜癌发病的危险因素, 大多内膜癌患者同时合并机体代谢紊乱。对于合并代谢性疾病的子宫内膜癌患者, 调节机体的代谢紊乱是否有利于子宫内膜癌患者的治疗, 进一步明确二甲双胍与脂联素联合作用与子宫内膜癌发生发展之间的关系, 对将来子宫内膜癌的临床治疗意义重大, 需要深入探寻。
(本文编辑:王 蕾)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|