目的: 研究高迁移率族蛋白B1(high mobility group box 1,HMGB1)在氧糖剥夺/复氧后对星形胶质细胞凋亡的影响,同时通过检测凋亡相关蛋白Bcl-2和Bax表达变化探讨其可能的作用机制。方法: 将体外培养新生大鼠大脑皮质星形胶质细胞分为正常组、模型组、干扰组、对照组,用携带大鼠HMGB1的短发夹RNA(short hairpin RNA,shRNA)慢病毒载体干扰星形胶质细胞抑制HMGB1表达后进行氧糖剥夺/复氧处理,氧糖剥夺6 h、复氧24 h后检测。通过Western blotting法检测RNA干扰效果,通过MTT细胞存活实验检测细胞损伤,通过TUNEL法检测细胞凋亡,最后通过Western blotting法检测凋亡相关蛋白Bcl-2和Bax表达。结果: 与正常组比较,模型组经过氧糖剥夺/复氧处理后星形胶质细胞内HMGB1表达明显升高( P<0.001), MTT实验检测细胞存活率下降( P<0.001),TUNEL法检测凋亡细胞数增多( P<0.001), 凋亡相关蛋白Bcl-2/Bax蛋白比值下降( P<0.001);与模型组比较,RNA干扰有效抑制HMGB1蛋白表达( P<0.001), MTT实验检测细胞存活率升高( P<0.001),TUNEL法标记凋亡细胞数减少( P<0.001), 凋亡相关蛋白Bcl-2/Bax蛋白比值升高( P<0.001)。结论: 氧糖剥夺/复氧后HMGB1的释放可以导致星形胶质细胞损伤及细胞凋亡,其作用机制可能与调控凋亡相关蛋白Bcl-2及Bax表达有关。
Objective: To investigate the effect of high mobility group protein box 1 (HMGB1) on apoptosis of astrocytes after oxygen glucose deprivation/reoxygenation (OGD/R), and to investigate the possible mechanism by evaluating the expression of apoptosis related protein Bcl-2 and Bax.Methods: The cerebral cortex astrocytes of neonatal rats were divided into normal group, model group, interference group and control group. Lentivirus vector of rat HMGB1 short hairpin RNA (shRNA) was used to suppress the HMGB1 protein expression in the astrocytes. Then the detection was made after astrocytes were deprived of oxygen and glucose 6 h, reoxygenation for 24 h. The effect of RNA interference was evaluated by Western blotting. The cell survival rate was measured by MTT assay. The apoptosis of astrocytes was determined by TUNEL assay. The expressions of Bcl-2 and Bax were detected by Western blotting.Results: Compared with the normal group, the protein expression of HMGB1 was significantly increased in model group after OGD/R ( P<0.001), the astrocytes survival rate was decreased ( P<0.001), the number of apoptotic cells labeled with TUNEL was increased ( P<0.001), and the ratio of Bcl-2/Bax was decreased ( P<0.001). Compared with the model group, RNA interference effectively inhibited the expression of HMGB1 in interference group ( P<0.001), the astrocytes survival rate was increased ( P<0.001), the number of apoptotic cells labeled with TUNEL was reduced ( P<0.01), and the ratio of Bcl-2/Bax was increased ( P<0.001).Conclusion: The apoptosis of astrocytes can be induced by HMGB1 after OGD/R, and the mechanism may be related to regulating the expression of apoptosis related proteins Bcl-2 and Bax.
星形胶质细胞是中枢神经系统的主要组成部分, 在维持中枢神经系统结构及功能的完整性中发挥重要作用。既往的研究证实, 星形胶质细胞有许多重要的生理功能, 例如维持中枢神经系统的新陈代谢, 回吸收细胞外环境的毒性物质, 维持和稳定血管结构, 促进神经突触的形成, 并且通过释放递质调节突触传递[1, 2, 3, 4, 5]。因此, 脑缺血后, 星形胶质细胞的功能紊乱会加重神经元的损伤, 脑缺血后减少星形胶质细胞的损伤对神经元保护有重要意义。研究证实, 氧糖剥夺/复氧(oxygen glucose deprivation/re-oxygenation, OGD/R)可以导致星形胶质细胞凋亡[6], 但其机制仍未完全明确。近年的研究发现, 氧糖剥夺后星形胶质细胞可以合成和分泌大量的高迁移率族蛋白B1(high mobility group box 1, HMGB1)[7, 8], HMGB1作为一个晚期炎症因子在脑缺血再灌注后对组织损伤发挥重要作用。那么, HMGB1是否也是脑缺血再灌注后引起星形胶质细胞凋亡的重要原因之一呢?本研究通过体外培养大鼠大脑皮质原代星形胶质细胞, 采用氧糖剥夺/复氧的方法体外模拟脑缺血再灌注的病理过程, 采用RNA干扰的方法沉默HMGB1的表达, 通过观察星形胶质细胞损伤及凋亡的变化, 探讨HMGB1在氧糖剥夺/复氧过程中对星形胶质细胞凋亡的影响。同时通过检测凋亡相关蛋白Bcl-2和Bax蛋白表达水平的变化, 探讨HMGB1在氧糖剥夺/复氧过程中促进星形胶质细胞凋亡可能的作用机制, 为进一步探讨促进脑缺血再灌注后星形胶质细胞凋亡的原因提供实验依据。
原代大鼠大脑皮质星形胶质细胞培养采用新生24 h内Sprague-Dawley(SD)大鼠, 购自山西医科大学实验动物中心, 许可证号:SCXK(晋)2015-0001。
DMEM高糖培养基、胎牛血清购自Gibco公司, 0.25%(质量分数)胰酶、Hank’ s液购自Hyclone公司, MTT试剂盒购自南京建成生物工程研究所, 小鼠抗胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)购自CST公司, 兔抗Bcl-2、兔抗Bax购自absin公司, 一步法TUNEL细胞凋亡检测试剂盒、二抗山羊抗小鼠FITC、DAPI(4’ , 6-二脒基-2-苯基吲哚)、青/链霉素及Western blotting相关试剂购自碧云天生物制剂公司。
将星形胶质细胞分为4组:(1)正常组:正常培养的星形胶质细胞; (2)模型组:氧糖剥夺6 h/复氧24 h处理正常星形胶质细胞; (3)干扰组:氧糖剥夺6 h/复氧24 h处理经过RNA干扰抑制HMGB1表达的星形胶质细胞; (4)对照组:氧糖剥夺6 h/复氧24 h处理阴性序列干扰的星形胶质细胞。单次实验每组3个样本, 每个实验重复不少于3次。
取24 h内新生SD大鼠, 断头取脑, 在置于冰面上含有Hank’ s液的玻璃培养皿中迅速剥离脑膜, 分离两侧大脑皮质, 剪碎脑组织后, 用0.25%(质量分数)胰酶消化30 min, 按1 :2比例用10%(体积分数)胎牛血清终止消化, 用巴氏管反复吹打脑组织块至单细胞悬液, 200目细胞筛过滤后1 000 r/min离心5 min, 弃上清液后, 用星形胶质细胞培养基[含10%胎牛血清和1%(体积分数)青/链霉素的DMEM高糖培养基]重悬, 采用差速贴壁的方法去除成纤维细胞后, 以2× 105/mL密度种植于50 mL培养瓶中。每隔5 d进行一次传代, 在进行氧糖剥夺实验前传代4~5次。
携带HMGB1短发夹RNA(short hairpin RNA, shRNA)序列的慢病毒和阴性对照shRNA序列的慢病毒由上海吉凯基因股份有限公司提供。HMGB1 shRNA序列如下:5'-GATCCCGAAGCACCCGGATGCTTCTTTCAAGAGAAGAAGCATCCGGGTGCTTCT-TTTTTGGAAA-3'。阴性对照shRNA序列对目前已知的mRNA无任何干扰作用, 序列由上海吉凯基因有限股份公司提供。以感染复数为50对星形胶质细胞进行转染, 转染后72 h检测HMGB1蛋白表达被抑制后开始进行实验。
4%(体积分数)多聚甲醛溶液固定星形胶质细胞15 min, PBS液洗涤5 min× 3次。0.1%(体积分数)的Triton X-100室温通透10 min, PBS液洗涤5 min× 3次。5%(体积分数)的山羊血清室温封闭30 min。滴加一抗小鼠抗GFAP(体积比1 :300)4 ℃过夜, PBS液洗涤5 min× 3次。滴加二抗山羊抗小鼠FITC(体积比1 :100)37 ℃孵育1 h, PBS液洗涤5 min× 1次, 用5 mg/L DAPI染料室温孵育10 min后PBS液洗涤5 min× 3次。抗淬灭封片剂封片, Olympus荧光倒置显微镜采集图像。
氧糖剥夺/复氧模型参照既往报道的实验方法并做部分改进[9]。实验开始前, 弃去星形胶质细胞培养基, 用PBS液冲洗2次后, 更换为DMEM无糖培养基, 置于含2%(体积分数)O2的三气培养箱中, 分别进行2 h、4 h、6 h的氧糖剥夺后, 更换为含10%胎牛血清的星形胶质细胞培养基, 复氧培养24 h后进行检测。
将星形胶质细胞以2× 104/孔的密度种植于96孔板内, 按实验设计分组处理后, 根据MTT试剂盒操作说明进行处理, 最后在酶标仪570 nm处检测光密度值(D), 计算细胞存活率。
将干预后的星形胶质细胞用PBS液洗涤5 min× 1次, 4%多聚甲醛溶液固定星形胶质细胞30 min, PBS液洗涤5 min× 3次, 0.1%的Triton X-100室温通透10 min, PBS液洗涤5 min× 2次。加TUNEL检测液, 37 ℃避光孵育60 min, PBS液洗涤5 min× 1次。加入含5 mg/L DAPI染料, 室温孵育10 min后, PBS液洗涤5 min× 3次, 抗淬灭封片剂封片, Olympus荧光倒置显微镜采集图像。所有细胞核均为蓝色荧光, 而TUNEL标记凋亡细胞显示红色荧光, 随机选取5个视野(× 200), Image-Pro Plus 软件分析图像, 计算凋亡率。
分别收集不同组别的星形胶质细胞, 用4 ℃的PBS液洗涤2次, 用细胞刮刀将贴壁生长的星形胶质细胞从培养瓶中刮离, 收集星形胶质细胞加入RIPA裂解液置于冰面上裂解30 min, 4 ℃低温12 000 r/min 离心15 min, 取上清液, 用BCA定量法测定蛋白浓度。12%(质量分数)SDS-PAGE 凝胶电泳分离蛋白条带, 将蛋白电转至PVDF膜上。5%(质量分数)脱脂奶粉37 ℃封闭90 min, 加一抗兔抗大鼠HMGB1(体积比1 :1 000)、兔抗大鼠Bcl-2(体积比1 :500)、兔抗大鼠Bax(体积比1 :500)、兔抗大鼠β -actin(体积比1 :1 000) 4 ℃过夜。TBST洗涤后, 辣根酶标记二抗37 ℃孵育90 min, Bio-Rad apparatus显影仪显影, Quantity One 4.6.2软件分析图像。
采用SPSS 19.0统计软件进行统计学分析, 结果以
取培养4代的大鼠皮质星形胶质细胞进行鉴定, 用星形胶质细胞标记物GFAP(绿色)标记星形胶质细胞, DAPI(蓝色)标记细胞核(图1), 结果示星形胶质细胞纯度达95%以上。
MTT检测细胞存活率显示, 与正常组对比, 经过氧糖剥夺2 h、4 h、6 h/复氧24 h处理后星形胶质细胞的存活率均明显下降(P< 0.001, 图2A), 并且随氧糖剥夺时间延长, 星形胶质细胞存活率逐渐降低, 其中氧糖剥夺6 h/复氧24 h时星形胶质细胞存活率最低。通过Western blotting检测氧糖剥夺2 h、4 h、6 h/复氧24 h后星形胶质细胞内HMGB1蛋白表达发现, 随着氧糖剥夺时间延长, 细胞内HMGB1蛋白表达量逐渐升高(P< 0.001, 图2B、C), 其中氧糖剥夺6 h/复氧24 h时星形胶质细胞内HMGB1表达最多, 结果显示HMGB1表达增多时星形胶质细胞存活率下降, 因此选择该时间点进行后续实验。
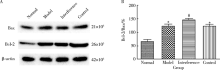
Western blotting检测显示(图3), 与正常组对比, 模型组星形胶质细胞内HMGB1表达明显升高(P< 0.001); 与模型组对比, 干扰组星形胶质细胞内HMGB1表达被明显抑制(P< 0.001), 而对照组HMGB1表达差异无统计学意义(P> 0.05)。结果提示OGD/R处理可以使星形胶质细胞内HMGB1表达显著升高, 携带HMGB1 shRNA的慢病毒成功抑制了HMGB1的表达, 而阴性序列慢病毒本身对HMGB1表达无明显影响。
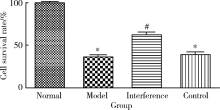
MTT实验检测细胞存活率显示(图4), 与正常组对比, 模型组星形胶质细胞的存活率明显下降(P< 0.001); 与模型组对比, 干扰组抑制HMGB1表达后, 星形胶质细胞存活率明显增加(P< 0.001), 而对照组星形胶质细胞存活率差异无统计学意义(P> 0.05)。结果提示OGD/R可以使星形胶质细胞存活率下降, 而OGD/R过程中抑制HMGB1表达可以增加星形胶质细胞存活率。
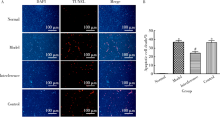
通过TUNEL法检测细胞凋亡(图5), 其中 DAPI(蓝色)标记所有细胞的细胞核, 而TUNEL (红色)标记凋亡细胞的细胞核。结果显示, 正常组几乎没有TUNEL标记的星形胶质细胞; 与正常组对比, 模型组TUNEL标记的星形胶质细胞比例明显增多(P< 0.001); 与模型组对比, 干扰组TUNEL标记的星形胶质细胞比例明显减少(P< 0.001), 而对照组TUNEL标记的星形胶质细胞比例差异无统计学意义(P> 0.05)。结果提示OGD/R可以促进星形胶质细胞的凋亡, 而抑制HMGB1表达可以减少OGD/R促进星形胶质细胞凋亡的作用。
Western blotting检测显示(图6), 正常组星形胶质细胞内Bcl-2、Bax蛋白表达水平均较低, 而经过OGD/R处理后星形胶质细胞内Bcl-2、Bax蛋白表达水平均有所升高。与正常组比较, 模型组星形胶质细胞内Bcl-2/Bax比值明显升高(P< 0.001); 与模型组比较, 干扰组星形胶质细胞Bcl-2/Bax比值明显升高(P< 0.001), 而对照组Bcl-2/Bax比值与模型组比较差异无统计学意义(P> 0.05)。结果提示, OGD/R处理可以使星形胶质细胞内抗凋亡蛋白Bcl-2及促凋亡蛋白Bax表达均升高, 总体表现为Bcl-2/Bax比值升高, 而RNA干扰抑制HMGB1表达后, OGD/R星形胶质细胞内Bcl-2/Bax比值进一步升高, 使Bcl-2、Bax蛋白比例重新调整, 发挥抗凋亡作用。
自研究发现HMGB1在组织损伤后发挥晚期内毒素作用以来[10], 越来越多的研究证实, HMGB1在脑缺血早期有加重炎症反应及组织损伤的作用, 如HMGB1可以介导兴奋毒性作用所致的急性损伤和炎症反应[11]、破坏血脑屏障[12]和促进神经元凋亡[13], 而在脑缺血后期, HMGB1通过促进神经干细胞的增殖[14]、血管内皮细胞的增殖及神经血管单元修复起到促进缺血脑组织修复的作用[15], 因此, 脑缺血早期抑制HMGB1的表达可以减少组织损伤。但是, 既往对脑缺血的研究主要集中于减少神经元的损伤, 而对胶质细胞损伤的关注尚少, 由于星形胶质细胞在中枢神经系统内有维持内环境稳定、回吸收毒性物质、调节和稳定血管结构、促进神经突触形成及释放递质等重要作用[1, 2], 因此减少星形胶质细胞损伤、维持其正常生理功能对减少脑组织损伤有重要作用。既往的研究证实, 脑缺血后星形胶质细胞可以主动合成和释放HMGB1[15], 而脑缺血也可以引起星形胶质细胞的凋亡[6], 那么脑缺血损伤后星形胶质细胞释放的HMGB1是否是导致其凋亡的因素之一呢?
本研究用含有10%胎牛血清的高糖培养基体外培养24 h内新生SD大鼠大脑皮质内星形胶质细胞, 可见星形胶质细胞贴壁生长, 通过免疫荧光标记特异性抗体GFAP鉴定其为星形胶质细胞, 并且纯度达95%以上用于后续实验。对体外培养的星形胶质细胞进行氧糖剥夺/复氧处理模拟脑缺血再灌注的病理过程, 结果显示, 随着氧糖剥夺时间延长, MTT实验检测星形胶质细胞的存活率逐渐下降, 与我们既往的研究结果一致[16], 提示随着氧糖剥夺时间的延长, 星形胶质细胞的损伤也逐渐加重, 同时, 随着星形胶质细胞损伤程度的加重, 细胞内HMGB1的表达也逐渐升高。
本研究以氧糖剥夺6 h/复氧24 h作为研究的时间点, 结果发现, 经过氧糖剥夺/复氧处理后, 星形胶质细胞内HMGB1的表达明显升高, 结果与既往脑缺血再灌注模型中星形胶质细胞内HMGB1表达升高结果一致[15], 而我们进一步证实在无其他细胞参与的条件下, 体外氧糖剥夺/复氧刺激就可以使星形胶质细胞自身合成HMGB1。
引起细胞损伤最常见的两种方式是坏死和凋亡。既往的研究证实, HMGB1在缺血再灌注的病理过程中能够促进不同组织细胞的凋亡。在肾缺血再灌注的研究中发现, 通过别嘌呤醇抑制HMGB1的表达, 可以减少缺血再灌注后肾小管上皮细胞的凋亡[17]。橙皮苷预处理可以通过抑制HMGB1表达减少缺血再灌注后心肌细胞的凋亡[18]。本研究通过MTT实验检测细胞的存活率及TUNEL法检测凋亡证实, 抑制HMGB1表达, 可以使氧糖剥夺/复氧星形胶质细胞的存活率提高, 并减少其凋亡, 提示氧糖剥夺/复氧过程中, 星形胶质细胞HMGB1的合成是促进其自身损伤和凋亡的重要因素之一。氧糖剥夺/复氧后星形胶质细胞存活率下降与细胞坏死和凋亡均有关, 目前我们研究证实在导致星形胶质细胞存活率下降的因素中细胞凋亡占有较大比重, 但由于细胞存活率与凋亡率尚不完全吻合, 考虑细胞坏死也参与细胞的损伤过程。结合既往体外实验证实HMGB1可以促进神经元凋亡[13], 此次研究我们进一步证实, 在缺氧条件下HMGB1同样有导致星形胶质细胞凋亡的作用, 并推测在脑缺血再灌注后HMGB1的表达同时具有促进神经元和星形胶质细胞凋亡的作用。
在凋亡的过程中, 有两个与凋亡的发生密切相关的蛋白, 即Bcl-2和Bax。两者比例的变化最终决定细胞是否发生凋亡, 其中Bcl-2为抗凋亡蛋白, 它的比例升高会抑制细胞的凋亡; Bax为促凋亡蛋白, 它的比例增高会促进细胞的凋亡[19]。研究证实, 稳定Bcl-2/Bax的比例可以抑制H2O2诱导的星形胶质细胞凋亡[19]。体外间充质干细胞与星形胶质细胞共培养, 可以通过间充质干细胞分泌IL-6抑制氧糖剥夺后星形胶质细胞的凋亡, 并且证实其作用机制与上调星形胶质细胞内Bcl-2的表达和下调Bax的表达, 最终使Bcl-2/Bax比例升高有关[6]。本研究经过氧糖剥夺/复氧处理后, 星形胶质细胞内Bcl-2和Bax的表达均明显升高, 而抑制星形胶质细胞HMGB1表达后, 星形胶质细胞内Bax表达减少更明显, 从而使Bcl-2/Bax的比例升高, 表明氧糖剥夺/复氧后抑制HMGB1表达, 可以通过上调Bcl-2/Bax的比例抑制星形胶质细胞的凋亡, 提示在氧糖剥夺/复氧过程中, 凋亡相关蛋白Bcl-2和Bax的表达变化可能参与了HMGB1促进星形胶质细胞凋亡的过程。
目前星形胶质细胞在脑缺血后脑保护过程中的作用越来越受到重视。保护星形胶质细胞免受缺血缺氧继发的凋亡损伤, 可能对提高脑组织对缺血损伤的耐受性、减轻脑组织的功能缺损有重要作用。结合既往研究发现, 减少HMGB1可以减轻脑缺血后的神经功能缺损[20], 推测其中部分原因可能与减少星形胶质细胞凋亡, 而使脑组织对缺血的耐受力提高有关, 而该种猜想尚有待于我们进一步研究。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|