目的: 建立小鼠血浆中8-甲氧基补骨脂素(8-methoxypsoralen,8-MOP)的高效液相色谱(high performance liquid chromatography,HPLC)测定方法,并应用于8-MOP在小鼠体内的药代动力学研究。方法: 以5-甲氧基补骨脂素为内标,Waters Symmetry®C18柱(250 mm × 4.6 mm,5 μm)分离,等度洗脱,流动相为甲醇-水(体积比55 :45),流速为1.0 mL/min,荧光检测器检测,激发波长与发射波长分别为334 nm和484 nm,内标法定量。60只雄性健康的ICR小鼠随机分为12组,对照组以1%(质量分数)吐温80灌胃给药,其余11组小鼠灌胃给药8-MOP(40 mg/kg),HPLC法测定给药后不同时间点小鼠血浆中8-MOP的浓度,DAS 2.0软件计算药代动力学参数。结果: 小鼠血浆中8-MOP在0.05~10.00 mg/L范围内线性良好( r=0.999 3), 检出限为0.015 mg/L;高、中、低3种浓度8-MOP的加标回收率为92.5%~100.6%;日内精密度为3.3%~8.2%,日间精密度为3.4%~6.7%;提取回收率为90.9%~92.0%;小鼠血浆样品在-80 ℃下至少可以保存15 d。小鼠灌胃给药后5 min即可在小鼠血浆中检出8-MOP(1.4 mg/L),给药2 h血药浓度达到最高峰值,且给药后24 h仍可检出(1.1 mg/L)。 t1/2为(39.21±3.65) h, Cmax为(2.31±0.02) mg/L, tmax为(2.00±0.00) h,AUC0-t为(33.34±1.19) (h·mg)/L。结论: 该方法准确、简便,适用于小鼠体内8-MOP药代动力学研究。
Objective: To establish a high performance liquid chromatography (HPLC) method for the determination of 8-methoxypsoralen (8-MOP) in mouse plasma and apply it to a pharmacokinetic study of 8-MOP.Methods: 8-MOP was separated on a Waters Symmetry®C18 column (250 mm × 4.6 mm, 5 μm) and determined by HPLC using isocratic elution, and 5-methoxypsoralen was used as internal standard. The mobile phase consisted of methanol-water (55 :45, V/V) at a flow rate of 1.0 mL/min. The excitation and emission wavelength of fluorescence detector were set at 334 nm and 484 nm respectively, and the internal standard method was used for quantitative analysis. In the study, 60 healthy ICR male mice were randomly divided into twelve groups. The mice in control group were administered intragastrically with 1% Tween 80, and the mice in the other eleven groups were administered intragastrically with 8-MOP (40 mg/kg). Plasma concentrations of 8-MOP in the mice at different time points after treatment were determined by HPLC. Pharmacokinetic parameters were calculated by DAS 2.0 software.Results: The calibration curve of 8-MOP was linear with a correlation coefficient of 0.999 3 over the concentration range of 0.05 to 10 mg/L, and the limit of detection was 0.015 mg/L. The average recoveries of 8-MOP at three different concentrations (0.10, 0.50, 2.5 mg/L) were from 92.5% to 100.6%. The intra-day precision of 8-MOP was from 3.3% to 8.2%, while the inter-day precision was from 3.4% to 6.7% at three spiked concentration levels. The extraction recoveries of 8-MOP were from 90.9% to 92.0%, and the plasma samples could be stored at -80℃ for 15 days at least at three spiked concentration levels. 8-MOP could be detected in mouse plasma 5 min after intragastrical administration to the mice (1.4 mg/L). The concentration of 8-MOP in the mouse plasma reached a maximum 2 h after administration, and 8-MOP could still be detected 24 h after administration (1.1 mg/L). t1/2 was (39.21±3.65) h, Cmax was (2.31±0.02) mg/L, tmax was (2.00±0.00) h, and AUC0-t was (33.34±1.19) (h·mg)/L.Conclusion: The proposed method is accurate and simple,suitable for pharmacokinetics of 8-MOP in mice.
甲氧基补骨脂素(methoxypsoralen, MOP)是从中药补骨脂中提取的补骨脂素的甲氧基衍生物。8-甲氧基补骨脂素(8-methoxypsoralen, 8-MOP)又称花椒毒素, 存在于多种常见的伞形科与芸香科植物(如蛇床子、白芷、枳实)中[1]。研究发现, 8-MOP具有镇痛抗炎、抗微生物、抗病毒、免疫调节及抗肿瘤等多种作用[2, 3, 4, 5], 同时, 8-MOP对乙酰氨基酚和可卡因导致的小鼠急性肝损伤具有明显的保护作用[6, 7], 此外, 8-MOP亦可用来治疗中重度银屑病[8]。目前, 对于8-MOP的检测, 多集中于化妆品和药材中其含量的测定[9, 10, 11, 12, 13, 14], 生物样品中测定的报道较少[15, 16]。鉴于8-MOP具有多种药理活性作用, 因此有着广阔的药用开发前景, 但8-MOP也具有一定的毒性[17, 18, 19, 20, 21, 22, 23], 而目前国内尚无8-MOP药物代谢动力学研究的报道。开展8-MOP的药代动力学研究, 获得其药代动力学参数, 有利于进一步研究8-MOP在生物体内的代谢过程及其生物学作用。本研究建立了一种准确、简便的小鼠血浆中8-MOP含量的高效液相色谱检测方法, 并用该方法对小鼠体内8-MOP进行了药代动力学分析。
仪器: Waters高效液相色谱仪(包括Waters 1525 Binary HPLC Pump, Waters 717 plus Autosampler, Waters 2475 Multi λ Fluorescence Detector)购自美国Waters科技有限公司, FA(N)/JA(N)系列电子天平购自上海民桥精密科学仪器有限公司, BF2000氮气吹干仪购自北京八方世纪科技有限公司, XW-80A旋涡混合仪购自海门市其林贝尔仪器制造有限公司, 4 ℃高速离心机购自美国Thermo Scientific公司, D-130型手持式超细匀浆器购自德国Wiggens公司。
试剂:8-MOP纯度99.55%, 购自成都曼斯特生物科技有限公司; 内标5-甲氧基补骨脂素(5-methoxypsoralen, 5-MOP)纯度98%, 购自成都曼斯特生物科技有限公司; 甲醇纯度≥ 99.9%, 购自美国Honeywell B& J公司。
色谱条件:色谱柱为Waters Symmetry® C18柱(250 mm × 4.6 mm, 5 μ m); 保护柱为Waters Symmetry® C18(20 mm × 3.9 mm, 5 μ m); 荧光激发波长334 nm; 荧光发射波长484 nm; 流动相为甲醇-水(体积比 55 :45); 流速1.0 mL/min; 柱温24 ℃; 进样量 10 μ L。
样品预处理:取小鼠血浆50 μ L, 加入1.0 mg/L内标溶液(甲醇配制)50 μ L和400 μ L甲醇, 室温下涡旋混匀3 min, 置于高速离心机中13 824 × g离心5 min。将上清液转入干净管中, 40 ℃氮气吹干, 200 μ L甲醇溶解残渣, 混匀3 min后置于高速离心机中13 824 × g离心5 min, 上清液经0.45 μ m尼龙过滤器过滤后进样分析。
用甲醇配制8-MOP标准储备液(1.0 g/L), 之后用甲醇稀释储备液, 配制不同浓度的8-MOP标准溶液。取空白小鼠血浆50 μ L, 加入不同浓度的8-MOP 标准溶液50 μ L, 配制浓度分别为0.05、0.10、0.25、0.50、1.0、2.5、5.0、10 mg/L的8-MOP标准系列, 处理方法如1.2所述。以8-MOP的浓度为横坐标, 8-MOP与内标的峰面积比值为纵坐标, 绘制工作曲线。分别以3倍和10倍噪声水平对应的8-MOP的浓度确定方法的检出限和定量限。
比较来自不同个体的空白小鼠血浆色谱图、空白小鼠血浆加内标色谱图、空白小鼠血浆加8-MOP和内标色谱图及给药后小鼠血浆色谱图, 考察小鼠内源性物质和给药后的代谢产物对8-MOP及内标测定的影响。
在空白小鼠血浆中加入不同浓度的8-MOP标准溶液50 μ L, 配制8-MOP浓度分别为0.10、0.50、2.5 mg/L的质控样品, 每种浓度取6个平行样, 处理方法如1.2所述, 连续分析3 d, 用加标回收实验考察方法的准确度, 日内精密度与日间精密度以测定结果的相对标准偏差(RSD)表示。
取空白小鼠血浆50 μ L, 分别于氮气吹干前后加入不同浓度8-MOP标准溶液, 使8-MOP浓度分别为0.10、0.50、2.5 mg/L, 每种浓度取6个平行样, 处理方法如1.2所述, 测定并比较氮气吹干前后8-MOP与内标的峰面积比值(分别记为a与b), 考察方法的提取回收率。
在空白小鼠血浆中加入不同浓度的8-MOP标准溶液与1.0 mg/L内标溶液各50 μ L, 使8-MOP浓度分别为0.10、0.50、2.5 mg/L, 每种浓度取6个平行样, 分别于室温及-80℃下保存。考察室温下放置6 h及-80℃下保存15 d小鼠血浆样品中8-MOP的稳定性。
在空白小鼠血浆中加入不同浓度的8-MOP标准溶液, 配制8-MOP浓度分别为0.10、0.50、2.5 mg/L的质控样品, 处理方法如1.2所述。在测定未知样品的过程中随行测定质控样品中8-MOP的浓度, 每10个未知样品穿插一个质控样品, 使其均匀分布在测定过程中。
雄性健康的SPF级ICR(institute of cancer research)小鼠, 体重18~22 g, 由北京大学医学部实验动物科学部提供。将8-MOP溶于1%(质量分数)吐温80中, 配制浓度为4.0 g/L的8-MOP混悬液。60只小鼠随机分成12组, 每组5只。小鼠给药前适应性饲养2 d, 自由摄食饮水。对照组以1%(质量分数)吐温80灌胃, 其余11组灌胃给药8-MOP(40 mg/kg), 给药后分别于 5 min、10 min、20 min、30 min、1 h、2 h、4 h、6 h、8 h、12 h及24 h取血, 迅速收集血液于肝素化离心管中, 13 824 × g离心10 min, 取血浆保存于-80 ℃冰箱, 待测。
方法的特异性结果如图1所示, 8-MOP与内标的色谱峰峰形良好, 可完全分离, 且血浆中的内源性物质对8-MOP及内标的测定无干扰。
8-MOP测定方法的准确度与精密度结果见表1。8-MOP的平均回收率为92.5%~100.6%, 日内与日间精密度测定结果的RSD分别为3.3%~8.2%和3.4%~6.7%。空白小鼠血浆中未检出8-MOP。
| 表1 准确度与精密度实验结果 Table 1 Accuracy and precision of the method |
在方法选定的色谱条件下, 8-MOP的浓度在0.05~10.00 mg/L范围内与8-MOP和内标的峰面积比值呈现良好的线性关系, 回归方程为:y = 5.101 6x + 0.265 4, r=0.999 3。检出限为0.015 mg/L, 定量限为0.05 mg/L。
小鼠血浆中低、中、高3种浓度8-MOP(0.10、0.50、2.50 mg/L)的提取回收率分别为90.9%、92.0%和92.0%(表2)。
| 表2 提取回收率实验结果(n=6) Table 2 Extraction recovery of 8-MOP in mouse plasma (n=6) |
8-MOP低、中、高3种浓度(0.10、0.50、2.5 mg/L)的小鼠血浆样品室温下放置6 h, 其稳定性数值分别为104.6%± 4.6%、96.7%± 3.3%和97.9%± 2.1%; 8-MOP低、中、高3种浓度(0.10、0.50、2.50 mg/L)的小鼠血浆样品-80℃放置15 d, 其稳定性数值分别为101.5%± 1.5%、100.7%± 0.7%和97.7%± 2.3%。实验结果表明, 小鼠血浆样品室温下至少可以放置6 h, -80℃冰箱中至少可以保存15 d。
实验结果表明, 低、中、高3种浓度(0.10、0.50、2.5 mg/L)8-MOP质控样品的回收率分别为104.7%、95.1%和99.8%, 测定结果的RSD分别为2.2%、5.4%和3.2%, 满足样品分析的需求。
| 表3 小鼠灌胃给药8-MOP的药代动力学参数 (n=5) Table 3 Pharmacokinetic parameters of 8-MOP in mice with a single intragastrical administration (n=5) |
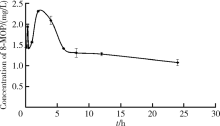
灌胃给药后5 min即可在小鼠血浆中检出8-MOP (1.4 mg/L), 且给药后24 h仍可在血浆中检出8-MOP(1.1 mg/L)。同时, 8-MOP在小鼠体内的血药浓度呈现双峰, 给药后20 min达到次峰值(1.9 mg/L), 给药2 h血药浓度达到最高峰值(2.3 mg/L), 其后, 血药浓度呈下降趋势:在给药后2~6 h期间, 血药浓度下降较为迅速, 给药6 h后血药浓度下降速度明显降低, 药时曲线逐渐趋于平缓。
目前, 8-MOP的检测方法主要有气相色谱、液相色谱、超高效液相色谱及其与质谱联用的方法, 多采用梯度洗脱和紫外检测器, 主要用于化妆品和中药中8-MOP含量的测定, 仪器配置要求高且样品的前处理方法较复杂。本研究以8-MOP作为主要研究对象, 以5-MOP为内标, 体积比为55 :45的甲醇-水体系为流动相, 等度洗脱, 建立了一种准确、简便、经济的小鼠血浆中8-MOP含量的高效液相色谱-荧光检测方法, 本方法的特异性、准确度、精密度、提取回收率等各项指标均可满足实际样品分析的需求, 方法对仪器配置的要求较低, 其应用范围更加广泛, 适用性更强。
为避免8-MOP对给药小鼠造成毒副作用影响实验结果, 同时考虑到了本方法的检出限水平, 本研究参考了文献中8-MOP的给药剂量(40 mg/kg)和给药方式[6, 7], 考察了单一剂量给药8-MOP在小鼠体内的药代动力学参数。结果表明, 灌胃给药后5 min小鼠血浆中即可检测出较高浓度的8-MOP(为最大浓度的62.3%), 给药后24 h小鼠血浆中8-MOP浓度仍维持在较高水平(为最大浓度的46.3%), 表明8-MOP在小鼠体内吸收较快而消除较慢。
本研究发现, 小鼠给药后得到的平均血药浓度-时间曲线出现双峰。药时曲线出现双峰的原因可能有多种[24]:首先, 药物自身的性质有可能导致药时曲线出现双峰, 如药物自身因素(如脂溶性等)导致吸收程度出现差异。其次, 肝肠循环也可能导致双峰的出现。肝肠循环即药物经胆汁进入肠道完成重吸收后, 经由门静脉再次返回肝。Qu等[25]通过实验验证了鸢尾苷代谢产物的药时曲线产生双峰的主要原因为肝肠循环。有研究发现, 胃肠蠕动与胃排空延迟也可能导致出现双峰[26], 胃肠蠕动指在空腹时的胃肠蠕动期给药引起再次收缩, 胃排空延迟指药物在进入小肠进行吸收前, 由于药物具有较高的水溶性而使得其在胃中停留时间较长。除上述可能的原因以外, 胃肠道对药物存在多吸收位点是目前药时曲线出现双峰现象最为广泛接受的机制。Godfrey等[27]将其作为理论基础, 应用于双峰药动学模型的建立; Nasiri-Toosi等[28]指出, 肠道对他克莫司的摄取由回肠和空肠两部分组成; Oo等[29]亦发现奥斯米韦在胃和小肠近远端均有良好的吸收。本研究灌胃给药配制的8-MOP为混悬液, 且8-MOP易溶于有机溶剂, 水溶性较差, 故药时曲线出现双峰的原因为胃排空延迟的可能性较小, 而8-MOP自身因素导致吸收程度出现差异的可能性更大一些。药物的药时曲线出现双峰的原因较复杂, 其真正的原因仍有待进一步研究确认。
(本文编辑:王 蕾)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|