目的: 探讨乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)以及PRCC合并癌栓患者的临床病理特点、治疗及预后。方法: 回顾性分析单中心2012年1月至2017年10月收治的75例PRCC的病例,其中男性55例,女性20例,年龄24~82岁,合并癌栓的患者16例,所有病例均为手术患者,病理诊断明确,随访数据完整。总结分析PRCC以及合并癌栓患者的临床病理特点、预后及影响因素。结果: 75例患者平均年龄(56.05±11.59)岁,平均体重指数(26±3) kg/m2,肿瘤平均最大径(5.17±3.85) cm,肿瘤最大径是否大于7 cm(69.6% vs.94.4%, P<0.001),有无淋巴结转移(<38% vs.98%, P<0.001)、有无肾上腺转移(0% vs.95.3%, P<0.001)、有无肺转移(0% vs.90.7%, P<0.001)、是否合并癌栓(<66.4% vs.93.5%, P<0.001)对PRCC患者3年生存率的影响差异有统计学意义。本研究患者中,合并癌栓患者16例,16例患者均为2型PRCC。合并癌栓的患者在有无伴随症状(62.5% vs. 22%, P=0.005)、肿瘤最大径(68.8% vs.13.3%, P<0.001)、有无肾上腺转移(18.8% vs.0.02%, P=0.029)、有无肺转移(18.8% vs.0%, P=0.008)、核分级( P<0.001)以及病理分型(100% vs.44.1%, P<0.001)方面,与不合并癌栓患者的差异有统计学意义。结论: 肿瘤最大径、淋巴结转移、肾上腺转移、肺转移、是否合并癌栓是PRCC患者3年生存率的影响因素;本研究中合并癌栓的PRCC患者均为2型,肿瘤直径更大、核分级更高、更容易发生远处转移。
Objective: To investigate the clinicopathological features,treatment and prognosis of patients with papillary renal cell carcinoma (PRCC) and PRCC-complicated with tumor thrombus.Methods: Single center retrospective analysis of 75 patients with PRCC treated from January 2012 to October 2017 was performed. There were 55 males and 20 females at an age range of 24-82 years. Sixteen PRCC patients were complicated with tumor thrombus. All the patients were with a surgery and had clear pathological diagnosis and detailed follow-up data. The clinicopathological features,prognosis and influencing factors of the patients with PRCC and PRCC complicated with tumor thrombus were analyzed and summarized.Results: The average age of the 75 patients was(56.05±11.59)years,the average body mass index (BMI) was (26±3) kg/m2, and the average tumor maximum diameter was(5.17±3.85)cm. There were significant differences between tumor maximum diameter larger than 7 cm and less than 7 cm (69.6% vs. 94.4%, P<0.001), lymph node metastasis and no lymph node metastasis (<38% vs. 98%, P<0.001), adrenal metastasis and no adrenal metastasis (0% vs. 95.3%, P<0.001), pulmonary metastasis and no pulmonary metastasis (0% vs.90.7%, P<0.001), complicated with and without tumor thrombus (<66.4% vs. 93.5%, P<0.001) on the effect of 3-year survival rate of the PRCC patients. In this study, there were 16 patients with type 2 PRCC complicated with tumor thrombus. There were significant differences in concomitant symptoms (62.5% vs. 22.0%, P=0.005), maximum tumor diameter (68.8% vs.13.3%, P<0.001), adrenal metastasis (18.8% vs. 0.02%, P=0.029), pulmonary metastasis (18.8% vs. 0%, P=0.008), nuclear grade ( P<0.001) and pathological type (100% vs. 44.1%, P<0.001) between the PRCC patients with and without tumor thrombus.Conclusion: There were significant differences in tumor diameter,lymph node metastasis,adrenal metastasis,pulmonary metastasis,pathological type,nuclear grade and tumor thrombus in the effect of the 3-year survival rate of PRCC patients. PRCC patients with tumor thrombus were more commonly suffered from type 2 PRCC, for whom the tumor diameter was larger,the nuclear grade was higher,and the distance metastasis happened more easily.
乳头状肾细胞癌(papillary renal cell carcinoma, PRCC)是仅次于透明细胞癌的第二大肾细胞癌亚型, 占全部肾细胞癌的15%~20%[1, 2]。肾细胞癌的一个突出特征是易向肾静脉系统的血管管腔内扩散, 形成静脉癌栓。在早期的肾细胞癌患者研究中, 4%~10%的病例癌栓延伸至肾静脉甚至下腔静脉, 并有可能向近心端迁移直至右心房[3]。很多研究的重点都是关于肾细胞癌合并癌栓的预后影响因素, 但是大多数研究关注的都是癌栓头端的位置和TNM分级的重要性[4, 5, 6, 7]。极少有研究探讨不同组织学类型的肾细胞癌合并癌栓患者的临床病理特点及预后情况。查阅文献, 国内关于PRCC合并癌栓的病例鲜有报道。
我们回顾性分析单中心2012年1月至2017年10月75例PRCC病例, 其中合并肾静脉癌栓16例, 分析PRCC以及PRCC合并癌栓患者的临床特点, 探讨PRCC合并癌栓的临床病理特征及诊疗策略。
研究对象为2012年1月至2017年10月北京大学第三医院收治的乳头状肾细胞癌手术患者, 数据来源为北京大学第三医院临床数据随访资料库, 纳入的均为已接受手术的、病理确诊为PRCC并且分型明确的患者, 分型不明及嗜酸细胞型PRCC均被排除。入组患者均有详实可靠的随访数据, 提取年龄、性别、体重指数(body mass index, BMI)、病理分型、TNM分期、核分级、淋巴结转移、是否合并癌栓等临床病理特征相关数据。TNM分期采用2009年版美国癌症联合会(American Joint Committee on Cancer, AJCC)标准, 核分级标准为Fuhrman分级系统, 病理分型采用的是《WHO泌尿系统和男性生殖器官肿瘤分类(2004版)》。肾静脉癌栓的分级采用Mayo分级(美国 Mayo 医学中心分级法)。最后入组患者75例, 其中合并肾静脉癌栓的16例。
采用SAS 9.4软件处理数据。对于连续变量计算均数和标准差, 对于分类变量计算各分类的数量及百分比, 对于生存变量绘制Kaplan-Meier曲线描述生存过程, 并使用Kaplan-Meier法计算3年生存率。二分类变量组间比较采用精确Fisher检验, 多分类采用似然比检验, 生存数据单因素分析采用Log-rank检验。显著性水平为双侧0.05。
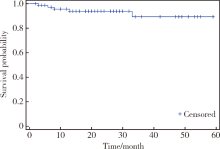
本研究75例患者, 其中男性55例(73.3%), 女性20例(26.7%), 平均年龄(56.05± 11.59)岁, 平均BMI(26± 3)kg/m2, 肿瘤平均直径(5.17± 3.85) cm, 其余基本特征见表1。随访2~59个月, 中位随访时间24个月, 至随访结束, 死亡5例, 存活70例, 3年生存率为93.3%, 总体生存曲线见图1。临床病理特征与生存率关系结果见表2, 其中肿瘤最大径是否大于7 cm(P< 0.001), 有无淋巴结转移(P< 0.001)、有无肾上腺转移(P< 0.001)、有无肺转移(P< 0.001)、PRCC分型(P=0.044)、是否合并癌栓(P< 0.001)对PRCC患者3年生存率的影响差异有统计学意义。
| 表1 75例PRCC患者的基本临床病理特征 Table 1 Clinicopathological features of 75 patients with PRCC |
| 表2 75例PRCC患者临床病理特征与生存率的关系 Table 2 Relationship between clinicopathological features and survival rate in 75 patients with PRCC |
2.2 1、2型PRCC的临床病理特征比较
本研究患者中, 1型PRCC共33例, 2型PRCC共42例, 两型病人在有无伴随症状(P=0.045)、肿瘤最大径(P< 0.001)、有无淋巴结转移(P< 0.001)、核分级(P< 0.001)以及是否合并癌栓(P< 0.001)方面的差异具有统计学意义。有伴随症状是指患者有血尿、腰痛等不适, 无伴随症状是指患者为检查发现, 无不适主诉。二者的临床病理特征比较见表3。通过表2可见, 1型PRCC的3年生存率100%, 2型PRCC的3年生存率为82.1%, 不同PRCC分型对生存率的影响有待进一步延长随访时间进行观察。
| 表3 1、2型PRCC临床病理特征比较 Table 3 Comparison of the clinicopathological features of type 1 and type 2 PRCC |
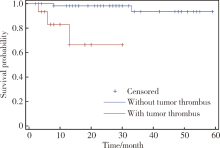
本研究75例患者中, 合并癌栓患者16例, 其中男性13例, 女性3例, 16例患者均为2型PRCC。合并癌栓的患者在有无伴随症状(P=0.005)、肿瘤最大径(P< 0.001)、有无肾上腺转移(P=0.029)、有无肺转移(P=0.008)、核分级(P< 0.001)以及病理分型(P< 0.001)方面, 与不合并癌栓患者的差异具有统计学意义, 详见表4。合并癌栓的患者生存时间显著缩短, 详见图2。
| 表4 PRCC合并癌栓患者与未合并癌栓患者的临床病理特征比较 Table 4 Comparison of clinicopathological features in patients of PRCC with tumor thrombus and without tumor thrombus |
Mancilla-Jimenez等[8]于1976年报道34例PRCC患者的临床病理学特点并进行命名, 使其成为一种独立的临床病理亚型。
PRCC起源于肾近曲小管和远曲小管的上皮细胞, 生长方式以乳头状为主, 沿肾小管壁生长, 常由肿瘤组织构成多少不等的小管和乳头状结构, 乳头轴心为纤维血管组织。PRCC形态学谱系比较广, 目前普遍应用的分型方法是Delahunt等[9]最先提出的, 而后WHO采用, 分型是根据细胞及结构特征, 将PRCC分为1型和2型。1型PRCC的细胞小而卵圆形, 被覆在乳头及管状结构表面, 核仁不明显, 胞质淡染嗜碱性, 砂粒体及乳头轴心泡沫巨噬细胞常见。2型PRCC乳头被覆假复层上皮, 肿瘤细胞较大, 胞质嗜酸, 核仁明显, 罕见钙化及乳头轴心泡沫巨噬细胞。与2型PRCC相比, 1型PRCC核分级低, 无明显核仁。
PRCC可发生于任何年龄, 高发年龄为52~66岁, 男性多于女性, 发病率约为2 :1[10]。大多数患者无症状, 在体检时偶然发现, 部分患者因血尿、胁腹部疼痛、腹部包块就诊。有一项关于亚洲人的PRCC研究发现, 在发病年龄方面, 2型PRCC的发病年龄比1型PRCC更高, 且具有统计学意义, 而两型PRCC在性别、BMI、合并症以及是否吸烟等方面的差异无统计学意义[11]。本研究的资料显示, 75例PRCC患者中1型33例, 2型42例, 平均发病年龄为(56.05± 11.59)岁, 其中男性55例, 女性20例, 男女发病率比约为2.75 :1, 无症状者52例, 有伴随症状者23例, 两型病人在有无伴随症状(P=0.045)方面的差异具有统计学意义, 但在BMI、性别及年龄方面差异无统计学意义。
PRCC 1型的肿瘤细胞较小, 胞质少, 核小, 核仁不清楚, 相当于Fuhrman核分级的1级和2级, 肿瘤级别低, 核分级低, 预后好。2型的肿瘤细胞较大, 胞质丰富, 相当于Fuhrman核分级的3级和4级, 肿瘤级别高, 核分级高, 预后差。有研究报道, 1型PRCC与2型相比, 肿瘤直径更小(P=0.009), TNM分期更低(P=0.004), Fuhrman核分级更低(P< 0.001), 坏死更少(P< 0.001)及血管淋巴侵犯更少(P=0.011)[12]。Sukov等[13]报道的395例PRCC中, 有无临床症状、是否伴有癌栓、肿瘤大小、肾周脂肪浸润、TNM分期、 Fuhrman分级和分型、有无区域淋巴结转移、有无远处转移以及是否发生肉瘤样变均与患者预后有关。日本学者报道[14]2型乳头状肾癌的恶性程度显著高于1型乳头状肾癌, 2型患者Fuhrman分级高, 血管侵犯多。
本研究的资料显示:PRCC的1、2型病人在有无伴随症状(P=0.045)、肿瘤最大径(P< 0.001)、有无淋巴结转移方面(P< 0.001)、核分级(P< 0.001)以及是否合并癌栓(P< 0.001)方面的差异具有统计学意义, 部分结果与国外的研究报道一致。本研究的数据关于两型患者在远处转移的差异上无统计学意义, 但入组病例中4例肾上腺转移、3例肺转移的均为2型PRCC, 可从侧面反映出2型PRCC的恶性程度更高、侵袭转移的风险更大。
关于不同组织学类型的、不同分级的肾细胞癌的临床病理及预后特点已经被广泛分析报道[15, 16, 17]。有研究报道组织学分型对肾细胞癌的预后无显著影响[16], 而有研究却认为乳头状肾细胞癌和嫌色细胞癌的预后要优于透明细胞癌[15, 17]。仅有很少的研究报道了组织学分型在肾细胞癌合并癌栓的患者中的影响[7, 18]。有研究发现, 乳头状肾细胞癌合并癌栓的患者预后要明显差于透明细胞癌或嫌色细胞癌合并癌栓的患者, 研究者称, 除了已知的淋巴结转移等预后预测因子, 在多因素分析中, 乳头状肾细胞癌也是不良预后的独立预测因素(HR=1.62, 95%CI: 1.01~2.61, P< 0.05)[19]。Margulis和他的同事分析了2 157例不同分级的乳头状肾细胞癌和透明细胞癌的患者资料, 结果发现乳头状肾细胞癌合并癌栓患者的5年肿瘤特异性生存率显著低于透明细胞癌(35% vs. 66%)[20]。最近有一项纳入了74例肾细胞癌合并癌栓患者的研究, 结果发现2型PRCC的组织学类型是不良预后的预测因素, 12例PRCC合并癌栓的患者全部是2型, 而且其中4例已经合并转移[18]。本研究中合并癌栓的PRCC患者16例, 均为2型PRCC, 合并癌栓的患者在有无伴随症状、肿瘤最大径、有无肾上腺转移、有无肺转移、核分级以及病理分型方面, 与不合并癌栓患者的差异具有统计学意义。合并癌栓患者的生存期显著缩短。
肾细胞癌合并癌栓的患者若不接受治疗, 预后非常差, 有文章报道平均的生存期仅5个月, 1年的肿瘤特异性生存率仅为29%[21]。积极的外科手术诊疗可以显著地改善肾细胞癌合并癌栓的患者预后, 如不合并转移, 5年生存率可达40%~65%[4, 22, 23, 24]。另外有研究数据显示, 单纯肾癌合并下腔静脉癌栓而未合并周围组织和器官的浸润且无淋巴结转移的患者行根治术后的5年生存30%~64%, 癌栓在下腔静脉内延伸的程度并不意味着肿瘤具有更高的恶性程度和较差的预后, 但是癌栓的延伸水平越高, 手术难度越大, 手术相关并发症的发生率也随之增加[4, 25]。本研究纳入的75例病例均为手术治疗患者, 总体预后良好。合并癌栓的患者术后的3年生存率低于66.4%。另外, 手术治疗效果良好的前提是过硬的外科技术与术中严格的无瘤原则。
PRCC术后辅以免疫治疗和化疗的疗效甚微, 有研究显示抑制表皮生长因子受体(epidermal growth factor receptor, EGFR)和血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)通路可能是一个潜在的治疗方向[26], 也有研究将舒尼替尼与索拉菲尼用于PRCC患者的治疗, 但是疗效较弱[27, 28]。有研究将舒尼替尼用于治疗非透明细胞癌, 其中包括 PRCC, 其有效率仅 11%, 平均无进展生存期为 7.8 个月[29]。近年来, MET 基因抑制剂开始用于治疗PRCC, 尤其是远处转移的PRCC, 还有将MET 基因抑制剂及EGFR 抑制剂联合治疗晚期PRCC, 但是其疗效有待进一步的临床试验证实[30]。
综上, 本研究总结了单中心PRCC以及合并癌栓患者的临床病理资料, 肿瘤直径、淋巴结转移、肾上腺转移、肺转移、分型、核分级、是否合并癌栓对PRCC患者3年生存率影响的差异有统计学意义。本研究中合并癌栓的患者均为2型PRCC, 肿瘤直径更大、核分级更高、更容易发生远处转移。目前PRCC合并癌栓患者的治疗以手术治疗为主, 辅助治疗方案需进一步在分子水平进行探索。本文的局限性在于纳入的均为接受手术的、随访数据完整的PRCC患者, 对于PRCC生存期的计算及影响因素判断存在偏移。
(本文编辑:刘淑萍)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|