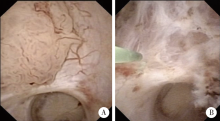
目的: 探讨输尿管软镜钬激光切除术治疗肾盂癌的应用价值,并总结治疗过程中的相关经验。方法: 回顾性分析北京大学第三医院2015年1月至2017年1月输尿管软镜治疗6例肾盂癌患者的临床资料,手术均由同一名医师操作。患者于全身麻醉下行输尿管软镜钬激光肾盂肿瘤切除术,采用200 μm钬激光传导光纤,设置功率为0.5~1.5 J,10~20 Hz,能量10~30 W。采用窄带成像技术寻找肿瘤,并检查切除是否满意。术后4~6周常规行二次输尿管软镜探查,对可疑病变部位行汽化烧灼。术后每6个月行输尿管软镜复查,同时行彩色多普勒超声、CT尿路造影(computed tomography urography,CTU)或磁共振水成像(magnetic resonance urography,MRU)检查,复查手术前连续3天每天进行尿液细胞学检查,检测尿路上皮肿瘤标记物[如尿液核基质蛋白22 (nuclear matrix protein 22,NMP22)]。术后组织病理为高危尿路上皮癌且肾功能正常的患者,给予全身辅助化疗6个周期。结果: 6例患者均顺利完成手术,手术时间45~115 min,平均77.5 min,失血量5~20 mL,术后住院2~5 d,平均3 d,术后随访13~34个月,平均22个月, 2例肿瘤复发。例5和例6两患者术后行全身辅助化疗,例5患者的组织病理为高级别尿路上皮癌,术后给予6个周期的全身化疗,化疗期间(术后4个月)患者出现局部复发,再次手术后1年未见复发;例6患者组织病理为低级别尿路上皮癌,但右肾上盏、下盏多发肿瘤,术后予6个周期的全身化疗,随访13个月未见复发。结论: 输尿管软镜钬激光切除术治疗肾盂癌的手术技术相对安全,适合孤立肾、肾功能不全等特殊病例以及低危的尿路上皮肿瘤患者,但其复发率较高,需严格掌握适应证。选择行内镜下切除术的高危尿路上皮癌患者,术后应积极予吉西他滨与顺铂(gemcitabine and cisplatin, GC)方案的全身辅助化疗,采用内镜治疗和全身辅助化疗联合的方法提高尿路上皮癌患者的总体生存率。全身化疗联合内镜手术有可能成为治疗上尿路尿路上皮癌的新治疗手段。
Objective: To summarize the experience of flexible ureteroscopic holmium laser resection in treatment of renal pelvic carcinoma and to evaluate its value in treatment of renal pelvic carcinoma.Methods: The clinical data of 6 patients with renal pelvic carcinoma treated in Peking University Third Hospital from January 2015 to January 2017 were retrospectively analyzed. The 6 patients were treated by the same experienced urologist and by flexible ureteroscopic holmium laser resection of renal pelvic tumors under general anesthesia. Regarding the intensity of the holmium laser, 10-30 W was generally used with settings of 0.5-1.5 J and 10-20 Hz. In general, a 200 μm end-firing holmium laser fiber was used. Narrow-band imaging (NBI) technique was applicated to search for tumors and check whether the excision was satisfactory. Routine “second flexible ureteroscopy” was performed after 4-6 weeks, and suspected lesions were referred for a biopy, then vaporized and cauterized. The ureteroscopy was examined every 6 months after operation, and color Doppler ultrasound, computed tomography urography (CTU) or magnetic resonance urography (MRU) were performed at the same time. The urine tumor cells were examined for 3 days before the operation, and the urine tumor markers, such as urinary nuclear matrix protein 22 (NMP22) were tested. For cases with high-risk urothelial carcinoma and normal renal function, and 6 cycles of systemic adjuvant chemotherapy were performed after operation.Results: All of the cases were successfully treated. The data were as follows: the operation time 77.5 min (45-115 min), the blood loss 10 mL (5-20 mL), and hospital stay after surgery 3 days (2-5 days). After 13-34 months’ follow-up, two patients had recurrent tumor recurrence and underwent resection operation. Two patients received systemic adjuvant chemotherapy after operation. Case 5 was histopathologically high grade urothelial carcinoma, and 6 cycles of systemic chemotherapy were given after operation. Local recurrence occurred during chemotherapy, and then endoscopic operation was performed, and no recurrence occurred in the follow-up for 12 months after reoperation. In case 6, the pathology was low grade urothelial carcinoma, but the case was multiple tumors in the right renal calyx and the lower calyx. Then 6 cycles of systemic chemotherapy were given, and no recurrence was found in the follow-up for 13 months.Conclusion: Transurethral flexible ureteroscopic holmium laser resection is relatively safe for the treatment of renal pelvic carcinoma. It is suitable for special cases of solitary kidney and renal dysfunction, as well as for patients with low risk urinary tract epithelial tumors, but the recurrence rate is high, and the indications need to be strictly controlled. Patients with high-risk urothelial carcinoma who underwent endoscopic resection are advised to receive systemic adjuvant gemcitabine and cisplatin (GC) regimen after surgery, in order to increase the overall survival rate. Systemic chemotherapy combined with endoscopic operation may become a new treatment for upper tract urothelial carcinoma (UTUC).
根治性肾、输尿管全长、膀胱袖状切除术是治疗肾盂癌的标准手术方式。2017年欧洲泌尿外科学会(European Association of Urology, EAU)的指南推荐[1], 对于孤立肾、肾功能不全、双侧上尿路肿瘤等特殊患者, 以及单发、体积较小的低危上尿路尿路上皮肿瘤患者, 可以选择保留肾单位的治疗方式。目前国内关于保留肾脏的肾盂癌手术的研究较少, 我们回顾性分析2015年1月至2017年1月北京大学第三医院6例行输尿管软镜下钬激光肾盂癌切除术的资料并复习相关文献, 现报道如下。
回顾性分析2015年1月至2017年1月北京大学第三医院采用输尿管软镜下钬激光肾盂癌切除术治疗肾盂癌的病例, 选择由同一名内镜操作经验丰富的医师操作, 患者依从性良好, 定期复查的患者。纳入标准:(1)孤立肾、双侧上尿路同时存在肿瘤、肾功能不全以及不能耐受较大手术的肾盂癌; (2)低危上尿路肿瘤, 单发, 直径< 1 cm, 组织病理为低级别肿瘤, CT尿路造影(CT urography, CTU)未见浸润征象, 能接受积极监测随访。术后行肾、输尿管全长、膀胱袖状切除术的患者不纳入本组, 暂无软镜钬激光治疗后行根治性手术的病例。本组共纳入6例患者, 男2例, 女4例, 年龄47~76岁, 平均61.3岁, 病例资料如下。
例1, 女性, 47岁, 2015年1月以“ 间断无痛性全程肉眼血尿2年” 主诉入院。2014年6月因左侧输尿管上段癌于外院行输尿管镜下钬激光切除术, 组织病理提示乳头状尿路上皮癌。入院后查血肌酐280~320 μ mol/L(正常值53~130 μ mol/L), CT检查提示右肾盂占位, 直径约1 cm。
例2, 女性, 69岁, 2015年9月以“ 间断无痛性全程肉眼血尿3个月” 主诉入院。2007年因左侧肾盂癌行根治切除术。2012年因膀胱癌行经尿道膀胱肿瘤电切术。2015年7月行经皮肾镜右侧肾盂肿物电切术, 组织病理提示高级别尿路上皮癌。入院后复查CT提示右侧肾盂肿物, 直径约2 cm(图1), 血肌酐95~143 μ mol/L。
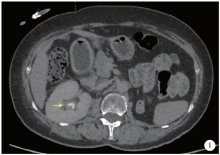 | 图1 病例2, 术前CT(2015年9月)检查提示右侧肾盂肿物(箭头所指)Figure 1 Preoperative CT (September 2015) showed carcinoma of right renal pelvis of case 2 (arrowhead) |
例3, 男性, 76岁, 2015年11月以“ 间断无痛性肉眼血尿3周” 主诉入院。既往有高血压病史20年, 2008年因颈动脉、右肾动脉狭窄行支架置入术。2013年因膀胱癌行经尿道膀胱肿瘤切除术。2015年7月因左侧肾盂癌行经皮肾镜肾盂肿物切除术, 组织病理提示低级别乳头状尿路上皮癌。入院后查CT提示左侧肾盂占位, 肾盂癌复发可能, 血肌酐315 μ mol/L。
例4, 女性, 59岁, 2016年3月以“ 无痛性肉眼血尿3个月” 主诉入院。既往乙型病毒性肝炎病史20余年, 高血压、甲状腺功能减低病史3年, 慢性肾小球肾炎病史5年余。血肌酐100~140 μ mol/L。输尿管软镜检查见左侧肾上盏一菜花状肿物, 直径约2 cm, 有蒂。
例5, 女, 66岁, 2016年7月以“ 间断无痛性肉眼血尿1月余” 主诉入院。2014年10月因左侧肾盂癌行腹腔镜左侧肾盂癌根治术, 组织病理提示高级别乳头状尿路上皮癌。入院查CT提示右肾盂占位, 直径约2.5 cm, 血肌酐80~120 μ mol/L。
例6, 男, 51岁, 2016年10月以“ 间断无痛性肉眼血尿1个月” 主诉入院。2014年9月因右侧输尿管占位行右侧输尿管镜下肿物切除术及左侧输尿管镜碎石术, 组织病理提示为低度恶性潜能的尿路上皮癌。入院后CT提示右侧肾下盏肿物, 直径约1.0 cm(图2)。肾动态显像提示左侧肾功能减低, 肾小球滤过率23.15 mL/min(参考值下限35 mL/min), 血肌酐70~110 μ mol/L。
患者全身麻醉取截石位, 先行膀胱镜检查, 观察膀胱内有无病变及输尿管口情况。膀胱、输尿管口观察无异常后, 退出膀胱镜, 经尿道置入F10(1 F≈ 0.33 mm)硅胶尿管, 避免膀胱过度充盈。以蒸馏水作为灌注液, 直视下经尿道插入输尿管硬镜(F8.0/9.8或F6.0/7.5), 进入膀胱后, 找到患侧输尿管口, 沿超滑导丝(COOK公司, 美国)进入输尿管, 探查输尿管全程, 缓慢上行至肾盂。留置超滑导丝, 退出输尿管硬镜, 沿导丝留置输尿管软镜导引鞘(F12/14或F14/16)至肾盂输尿管连接部。沿软镜导引鞘置入带有窄带成像技术(narrow-band imaging, NBI)的电子输尿管软镜(URF-V, Olympus公司, 日本), 观察肾盂及各个肾盏。在传统白光下寻找肿物或可疑病变, 再切换至NBI模式寻找、观察肿物或可疑病变, 包括肿瘤周围白光下不易发现的微小卫星灶。找到肿物后, 首先用NGage镍钛合金取石网篮(COOK公司, 美国)取组织留做病理检查。沿输尿管软镜操作通道置入200 μ m钬激光传导光纤, 设置为0.5~1.5 J、10~20 Hz、能量10~30 W, 在白光下行钬激光肿物切除术。切除过程中以整块切除为主, 肿瘤较大时, 以烧灼汽化为主。用NGage镍钛合金取石网篮将切除的肿瘤组织取出, 行常规组织病理检查。在NBI模式下检查切除是否满意, 要求完全切除肿瘤瘤体, 烧灼肿瘤基底及其周边0.5 cm。观察无明显出血后, 退出输尿管软镜, 输尿管留置F6/24 cm或26 cm双J管。术后1~2天复查泌尿系X线平片, 观察双J管位置。
术后4~6周常规行二次输尿管软镜探查、病变汽化烧灼术, 首先常规利用NGage镍钛合金取石网篮取原切除部位或可疑病变部位的组织送病理检查, 然后烧灼病变部位。术后每6个月复查输尿管软镜, 同时行彩色多普勒超声、CTU或磁共振泌尿系水成像(MR urography, MRU)检查, 复查手术前连续3天每天进行尿液细胞学检查, 检测尿路上皮肿瘤标记物(如NMP22), 评估肿瘤复发情况。高危、肾功能正常的肾盂癌患者有两例, 例5患者组织病理为高级别尿路上皮癌, 例6患者组织病理为低级别尿路上皮癌, 但右侧肾上盏、下盏多发肿瘤。两例患者术后请肿瘤化疗科医师会诊, 给予全身辅助化疗6个周期, 其余高危患者因肾功能差或患者拒绝未予全身辅助化疗。
6例患者均手术成功, 手术时间45~115 min, 平均77.5 min, 术中出血量5~20 mL, 无严重并发症(表1)。术后住院2~5 d, 平均3 d。术后组织病理均为尿路上皮癌, 结合术前影像学资料和术中软镜观察, 肿瘤直径最大约2.5 cm, 例1、例2、例5为高级别尿路上皮癌(图3), 例3、例4、例6为低级别尿路上皮癌(图4)。术后4~6周二次软镜均未发现肿瘤复发, 原切除部位给予再次烧灼。术后密切随访, 随访时间13~34个月, 中位随访时间22个月, 有两例发现复发:例2术后6个月发现肾盂肿瘤复发伴膀胱肿瘤, 行输尿管软镜肾盂肿瘤钬激光切除术及膀胱肿瘤等离子切除术, 之后随访20个月未见复发; 例5患者组织病理为高级别尿路上皮癌, 术后给予6个周期的全身化疗, 化疗期间(术后4个月)患者出现局部复发, 再次手术后一年未见复发。例6患者组织病理为低级别尿路上皮癌, 但右肾上盏、下盏多发肿瘤, 术后予6个周期的全身化疗, 随访13个月未见复发。例1、例3、例4、例6分别随访34、24、20、13个月, 均未见复发。
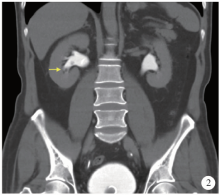 | 图2 病例6, 术前CT(2016年10月)检查提示右肾下盏肿物(箭头所指)Figure 2 Preoperative CT (October 2016) showed carcinoma of right lower renal calyx of case 6 (arrowhead) |
 | 图3 病例1, 术后组织病理(2015年1月)提示高级别尿路上皮癌(HE × 100)Figure 3 Postoperative pathology (January 2015) suggested high-grade urothelial carcinoma of case 1 (HE × 100) |
 | 图4 病例6, 术后组织病理(2016年10月)提示低级别乳头状尿路上皮癌(HE × 100)Figure 4 Postoperative pathology (October 2016) suggested low-grade papillary urothelial carcinoma of case 6 (HE × 100) |
| 表1 6例患者的临床资料 Table 1 Clinical data of 6 patients |
肾盂癌约占尿路上皮肿瘤的5%~10%[2, 3], 其中90%以上为尿路上皮癌。上尿路尿路上皮癌(upper tract urothelial carcinomas, UTUC)的标准手术方法是切除患肾及输尿管全长, 以及输尿管开口部位的膀胱壁[4]。近年来随着腹腔镜技术的快速发展, 开放性肾盂癌根治术的应用逐渐减少[5]。对于孤立肾、肾功能不全的肾盂癌患者, 可选择保留肾脏的手术。保留肾脏的肾盂癌手术方法主要包括经皮肾镜切除术和输尿管软镜切除术。最新的输尿管软镜镜体纤细、弯曲度大且图像清晰, 可观察肾盂及各个肾盏, 联合钬激光能精确切除肾盂肿瘤。
目前国内应用输尿管软镜进行肾盂癌治疗的研究较少。潘东亮等[6]应用输尿管软镜联合绿激光治疗孤立肾肾盂肾盏癌4例, 术后并发症少, 组织病理均为低级别尿路上皮癌, 术后随访, 1例患者术后4个月复发。目前国内未见大样本量的临床研究。
Cutress等[7]报道了应用输尿管镜及经皮肾镜治疗UTUC的单中心20年应用研究, 1991年1月至2011年4月, 63例患者行输尿管镜肿瘤切除术, 10例患者行经皮肾镜肿瘤切除术, 平均随访54个月, 复发率为68%, 5年总生存率和肿瘤特异性生存率分别为 69.7%和88.9%。Yakoubi等[8]荟萃了美国、法国等8个研究中心共1 002例UTUC患者的临床资料, 其中322例行内镜下保留肾脏手术, 680例行肾盂癌根治性切除术, 两组之间总生存率和肿瘤特异性生存率差异无统计学意义, 但保肾组的局部复发率为6%~71%, 根治性手术组的复发率为1%~18%, 保肾组的复发率显著高于根治性手术组。Verges等[9]分析了近5年的相关文献总结, 内镜下治疗UTUC的复发率较高, 原位复发和膀胱复发都较常见, 随着随访时间的增加会更明显, 某些研究中心的复发率甚至达到90%[10]。
Gadzinski等[11]对73例UTUC进行分组对照研究, 其中62例发现肿瘤时即行根治切除术, 11例患者先予内镜下切除术, 有复发后再行根治性手术, 平均延迟10个月, 随访58~75个月, 内镜治疗后根治组和初始根治组的5年生存率分别为64%和59%, 而5年肿瘤特异性和无转移生存率分别为91% vs. 80%和77% vs. 73%, 两组之间差异无统计学意义。Iborra等[12]对采用开放保肾手术及内镜下保肾手术治疗UTUC的54例患者资料进行了meta分析, 结果认为肿瘤的位置及既往有无多次膀胱癌病史是影响肿瘤进展及复发的主要因素, 肾盂癌较输尿管癌更易复发及进展, 肾盂癌患者术后复发率较输尿管癌患者高5倍。Gadzinski等[13]经过长期的随访(中位随访时间77个月)研究结果显示, 内镜组与根治组中低级别尿路上皮癌患者5年无转移生存率相比差异无统计学意义(94% vs. 88%), 而对于高级别尿路上皮癌患者, 根治组与内镜组的5年生存率都比较低(47.8% vs. 25%), 分析认为尿路上皮癌的组织病理分级是影响内镜治疗疗效的主要因素。
输尿管软镜治疗肾盂癌的绝对适应证包括[12]:(1)孤立肾肾盂尿路上皮癌患者; (2)双侧发病的肾盂尿路上皮癌患者; (3)一般情况较差, 无法耐受肾盂癌根治术的患者; (4)肾功能严重不全, 无法行一侧肾切除的患者。而对于对侧肾功能正常, 单发病灶, 病灶< 1 cm且组织病理检查提示低级别尿路上皮癌、影像学检查呈黏膜浅表生长、无浸润性表现的患者, 也可以行内镜下肿物切除手术。本组6例患者, 例2、例5为孤立肾患者, 例1为双侧上尿路肿瘤患者, 例3为严重肾功能不全患者, 例4患者有双侧慢性肾炎病史伴有肾功能不全, 例6患者对侧肾功能较差, 均符合内镜治疗肾盂肿瘤的适应证, 但是, 其中有5例肿瘤直径≥ 1 cm, 最大者为2.5 cm, 超过EAU指南推荐的治疗UTUC的标准。随着钬激光的应用和发展, 我们认为体积较大的肿瘤并不是软镜治疗的禁忌, 通过适当提高钬激光的能量设置、配合使用NGage镍钛合金网篮、提高肿瘤汽化切除的效率, 仍可以达到适当时间内切除肿瘤的目的。针对肿瘤直径> 2 cm或位于最下盏软镜不易到达部位的肿瘤, 建议使用经皮肾镜的方式。
本研究6例患者, 手术均顺利完成, 无严重并发症出现。我们认为应注意以下几个问题:(1)应严格控制适应证, 要求患者依从性好, 沟通良好, 术后可以严格定期复查。对于复查随访的患者, 术前准备要充分, 常规术前连续3天进行尿液细胞学检查, 查尿路上皮肿瘤标记物(如NMP22)。如果尿液细胞学检查阳性或NMP22阳性, 术中应仔细寻找可疑病变部位, 并予以钬激光切除或烧灼汽化。行输尿管镜探查前, 应严格进行膀胱镜探查, 本组病例中例2患者随访复查发现膀胱尿路上皮癌, 行膀胱肿瘤切除。(2)手术中应用带有NBI[14, 15, 16]的电子输尿管软镜URF-V, 可以发现普通白光成像无法发现或容易漏诊的尿路上皮肿瘤, 尤其针对一些扁平病变及微小的乳头状病变[17, 18], NBI可以将尿路上皮肿瘤的检出率提高20%[16]。(3)采用200 μ m光纤, 以0.5~0.8 J、20 Hz、10~16 W游离并切除肿瘤, 切除深度至黏膜下层(图5)。钬激光能量的设置主要参考前列腺钬激光剜除术[19], 剜除时采用2 J、20 Hz, 止血时采用 0.5 J、20 Hz, 并通过调整光纤和组织之间的距离达到止血的目的。针对体积较大的肿瘤, 汽化烧灼肿瘤的能量设置为:1~1.5 J、20 Hz、20~30 W。对体积较大的肿瘤首先采用钬激光切除、汽化, 残留的组织可采用NGage镍钛合金取石网篮多次抓取, 减少残留组织细胞种植的风险, 该网篮比软镜下常用的活检钳抓取容量大、方便高效, 可提高检出率。(4)本研究中心曾提出“ 输尿管肾盂软镜下肿瘤二次切除” 的方案[20], 通常于术后4~6周行二次输尿管软镜探查, 如发现肿瘤则行钬激光肿瘤切除术, 如无新生肿物, 原切除部位常规取活检并钬激光烧蚀以降低复发风险。(5)对于行内镜下切除术的高危尿路上皮癌患者, 术后积极予全身辅助化疗, 采用吉西他滨与顺铂(gemcitabine and cisplatin, GC)方案。本组患者有两例术后接受全身化疗, 此两例患者为高危肾盂癌患者, 肾功能正常, 化疗效果良好。
基于多中心的荟萃分析[21]结果显示, 以顺铂为基础的术后辅助化疗方案与单纯手术相比, 辅助化疗显示57%的益处(HR=0.43, 95% CI 0.21~0.89, P=0.023), 提示含顺铂的术后辅助化疗可以提高尿路上皮癌患者的总体生存率, 但辅助化疗期间需密切监测肾功能。研究表明, 根治性手术的新辅助化疗和围手术期化疗均对UTUC患者的总体生存和无瘤生存收益[22, 23]。本组两例接受化疗的病例, 再次行输尿管软镜复查时未见肿瘤复发。目前尚无全身化疗联合内镜手术治疗处理UTUC的系统性研究, 但是, 参考膀胱癌的治疗经验和全身化疗联合根治术处理UCUC的经验, 全身化疗联合内镜手术有可能成为治疗UTUC新的治疗手段。
输尿管软镜治疗肾盂癌要求术者有熟练的输尿管软镜操作技术, 该术式具有创伤小、恢复快、并发症少的优点, 尤其适合于孤立肾、慢性肾功能不全、双侧上尿路肿瘤等患者。此外, 针对低危UTUC患者可优先选择保肾的内镜手术, 但该术式复发风险较高, 需要严格控制手术适应证, 术前应与患者及家属充分沟通, 术后密切随访。针对选择行内镜下切除术的高危尿路上皮癌患者, 术后积极予GC方案的全身辅助化疗, 采用内镜治疗和全身辅助化疗联合的方法, 提高尿路上皮癌患者的总体生存率, 有可能成为治疗UTUC新的治疗方式。在以后的工作中, 需要完善多中心、严格分组、规范手术方案的长期随访的大样本量研究, 以便更好地判断其远期疗效。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|