目的: 分析北京大学第三医院泌尿外科收治的超高龄(≥80岁)前列腺癌患者的围手术期参数、术后控尿功能恢复及肿瘤学预后,探讨中国人群超高龄前列腺癌患者接受腹腔镜前列腺根治性切除术治疗的安全性和有效性。方法: 选择2007年1月至2016年12月于北京大学第三医院因前列腺腺癌行腹腔镜前列腺根治性切除术的超高龄(≥80岁)患者进行回顾性分析,纳入标准为患者年龄≥80岁,经组织病理学检查确诊为前列腺腺癌,临床资料齐备。所有患者均经腹膜外途径行腹腔镜前列腺根治性切除术,收集患者临床资料、围手术期参数、术后病理资料等。术后3个月、6个月和1年对患者控尿功能恢复情况进行随访,定期检测血清前列腺特异性抗原(prostate specific antigen, PSA)水平,将生化复发定义为连续两次血清PSA水平大于0.2 μg/L者,应用Kaplan-Meier生存曲线分析患者无生化复发生存率和总生存率,多因素COX回归分析影响超高龄前列腺癌患者术后生化复发的危险因素。结果: 所有51例患者年龄(81.6±1.6)岁,穿刺前PSA (15.19±13.68) μg/L,穿刺Gleason评分为6分、7分和≥8分者分别为14例(27.5%)、19例(37.3%)和18例(35.3%),临床分期为T1、T2和T3期者分别为6例(11.8%)、31例(60.8%)和14例(27.5%),ASA分级Ⅰ级者6例,Ⅱ级者45例。所有患者均完成手术,手术时间(189.6±69.1) min,手术出血量(169.9±163.5) mL,11例(21.6%)患者发生围手术期并发症。通过超高龄前列腺癌患者腹腔镜前列腺根治性切除术(laparoscopic radical prostatectomy,LRP)术后的大体标本病理进行分析,术后病理分期T2期者29例(56.9%),T3期22例者(43.1%),其中包膜侵犯者18例(35.3%),精囊侵犯者4例(7.8%);大体病理Gleason评分6分、7分和≥8分者分别为8例(15.7%)、21例(41.1%)和22例(43.1%),术后病理切缘阳性者14例(27.5%)。截止2017年10月术后随访10~118个月,中位随访时间42个月,术后3个月、6个月和1年超高龄前列腺癌患者行LRP术后的尿控率分别为64.7%(33/51)、82.4%(42/51)和 92.2%(47/51)。在随访过程中,12例(23.5%)超高龄前列腺癌患者LRP术后出现生化复发,平均生化复发时间为40.9个月;4例(7.8%)患者在随访过程中死亡,其中1例(2.0%)患者因前列腺癌进展死亡,3例(5.9%)患者因其他疾病死亡。经多因素COX回归分析,影响超高龄前列腺癌患者术后生化复发的危险因素主要为高PSA水平( P=0.019)、病理分期≥T3期( P =0.017)和切缘阳性( P =0.020)。结论: 对选择恰当的超高龄前列腺癌患者施行腹腔镜前列腺根治性切除术是可行的,并且远期肿瘤控制情况良好,高PSA水平、病理分期≥T3期和切缘阳性可能是超高龄前列腺癌患者术后生化复发的独立危险因素,但此结论尚需大样本量的前瞻性临床研究证实。
Objective: To assess the perioperative outcome, continence recovery and oncologic outcome of Chinese patients aged 80 years or older treated with radical prostatectomy for prostate cancer.Methods: We retrospectively evaluated the octogenarian patients who recieved biopsy for prostatic carcinoma and underwent laparoscopic radical prostatectomy from 2007 to 2016. We collected the data of clinical variables, perioperative parameters and postoperative pathological results for the octogenarian patients. We recorded and analyzed the recovery of urinary continence of the patients 3 months, 6 months and 1 year after surgery. Biochemical progression was defined as postoperative prostate specific antigen (PSA) greater than 2 μg/L for 2 times. We evaluated the non-biochemical recurrence survival rate and overall survival rate by Kaplan-Meier survival curve analysis for the patients aged 80 years or older. Multivariable COX regression analyses were used for evaluating the influence factors of biochemical recurrence after laparoscopic radical prostatectomy.Results: For all the 51 patients, the average age was (81.6±1.6) years,and prebiopsy PSA was (15.19±13.68) μg/L. There were 14 cases (27.5%), 19 cases (37.3%) and 18 cases (35.3%) for biopsy Gleason score 6, 7 and ≥8. There were 6 patients(11.8%) with clinical stage T1, 31 patients (60.8%) with clinical stage T2 and 14 patients (27.5%) with clinical stage T3.According to American Society of Anesthesiologists (ASA) classification, grade Ⅰ was in 6 patients and grade Ⅱ in 45 patients. All the octogenarian patients received extra-peritoneal laparoscopic radical prostatectomy. The average operation time was (189.6±69.1) min, the estimated blood volume was (169.9±163.5) mL, and 11 patients (21.6%) had perioperative complications. There were 29 cases (56.9%) and 22 cases (43.1%) staged for pT2 and pT3 based on postoperative pathological test. Of the pT3 patients, 18 (35.3%) and 4 (7.8%) were pT3a and pT3b.Eight cases (15.7%) presented Gleason score 6,21 cases (41.1%) 7 and 22 cases(43.1%) ≥8. Fourteen cases were positive surgical margin patients after surgery. Overall, the median follow up was 42 months. The continence rate of the octogenarian patients was 64.7%, 82.4% and 92.2% for 3 months, 6 months and 12 months after the surgery. Twelve cases (23.5%) had biochemical recurrence and 4 cases (7.8%) died in the follow up. There was 1 patient who died of prostate cancer progression and 3 died for other reasons. PSA ( P=0.019), pT≥T3 ( P=0.017) and positive surgical margin ( P=0.020) were independent risk factors for biochemical recurrence of the octogenarian prostate cancer patients according to multivariable COX regression analysis.Conclusion: For well selected octogenarian prostate cancer patients, laparoscopic radical prostatectomy was a feasible treatment option. Octogenarian patients who received laparoscopic radical prostatectomy showed good oncologic outcome. PSA, pT≥T3 and positive surgical margin were independent risk factors for biochemical recurrence of octogenarian prostate cancer patients.
前列腺癌是老年男性最常见的恶性肿瘤之一, 随着我国老龄化进程的加剧, 越来越多的高龄前列腺癌患者被检出[1]。腹腔镜前列腺根治性切除术(laparoscopic radical prostatectomy, LRP)是治疗局限性前列腺癌的标准术式, 目前国内外前列腺癌诊疗指南虽未对施行LRP的年龄作硬性限制, 但预期寿命是决定局限性前列腺癌患者选择初始治疗的决定因素之一, 对于预期寿命≥ 10年的前列腺癌患者建议施行手术[2, 3]。不可否认, 部分超高龄(≥ 80岁)前列腺癌患者满足预期寿命≥ 10年的条件, 但是若施行LRP, 其围手术期风险较大, 远期肿瘤学及功能学预后无法明确预知。目前尚未见针对中国人群超高龄(≥ 80岁)前列腺癌患者接受LRP手术的围手术期参数、控尿功能恢复和肿瘤学预后的相关报道, 本研究回顾性分析北京大学第三医院泌尿外科2007年至2016年收治的超高龄前列腺癌患者的围手术期参数及术后随访情况, 拟探讨中国人群超高龄前列腺癌患者接受LRP治疗的安全性和有效性。
选择2007年1月至2016年12月于北京大学第三医院因前列腺腺癌行腹腔镜前列腺根治性切除术的超高龄(≥ 80岁)患者进行回顾性分析。纳入标准为患者年龄≥ 80岁, 经组织病理学检查确诊为前列腺腺癌, 并且临床资料齐备者。排除标准为患者术前已行新辅助内分泌治疗或放疗, 存在远处转移等。最终入组患者51例, 临床资料包括患者年龄、前列腺特异性抗原(prostate specific antigen, PSA)、穿刺Gleason评分、临床分期、美国麻醉医师协会(American Society of Anesthesiologists, ASA)分级等。
所有患者均经腹膜外途径行腹腔镜前列腺根治性切除术, 应用《美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)指南》决定术中是否行盆腔淋巴结清扫术, 对于术前评估及术中探查可保留神经血管束的患者采用筋膜内或筋膜间两种方法予以保留; 术中应用3-0缝线全层间断或连续缝合膀胱颈与尿道内口, 术后留置尿管, 围手术参数包括手术时间、出血量及围手术期并发症发生情况等, 应用Clavien分级系统评估围手术期并发症严重程度[4]。
前列腺癌根治术后标本浸入4%(体积分数)甲醛溶液固定48 h, 使用墨汁均匀涂染前列腺表面, 切除前列腺上下断端(膀胱颈端、尿道端)各10 mm, 自尖部开始垂直于尿道逐层切取前列腺组织, 层厚3 mm, 每个断面以尿道为中心切取合适大小放于取材盒内进行后续处理。将所切得前列腺切片石蜡包埋固定, 切取蜡块表面置入载玻片行HE染色制成大体病理切片, 由两位泌尿系统专业病理医师读片并出具诊断结果。病理报告包括前列腺肿瘤Gleason评分、肿瘤包膜侵犯情况、精囊侵犯情况、切缘情况等。
术后3个月、6个月和1年对患者控尿功能恢复情况进行随访, 依照如下评价标准:(1)完全控尿:患者全天无尿失禁, 不需要使用尿垫; (2)轻度尿失禁:腹压增高时有尿液漏出, 每日需使用< 3个尿垫; (3)重度尿失禁:正常活动时即有尿液不自主流出, 每日需使用≥ 3个尿垫。
术后定期检测血清PSA水平, 每6个月行胸片、全身骨扫描等检查; 将生化复发定义为连续两次血清PSA水平大于0.2 μ g/L者, 记录随访患者无生化复发生存率、肿瘤特异性生存率和总生存率。
采用SPSS 19.0软件分析数据, 计量资料以
所有51例患者年龄(81.6± 1.6)岁, 其中80~81岁者31例(60.8%), ≥ 82岁者20例(39.2%); 穿刺前PSA(15.19± 13.68) μ g/L, 其中< 10 μ g/L者24例(47.1%), 10~20 μ g/L者16例(31.4%), > 20 μ g/L者11例(21.6%); 穿刺Gleason评分为6分、7分和≥ 8分者分别为14例(27.5%)、19例(37.3%)和18例(35.3%); 临床分期为T1、T2和T3期者分别为6例(11.8%)、31例(60.8%)和14例(27.5%), ASA分级Ⅰ 级者6例, Ⅱ 级者45例。所有患者均完成手术, 手术时间(189.6± 69.1) min, 手术出血量(169.9± 163.5) mL, 11例(21.6%)患者发生围手术期并发症, 其中1例患者发生两种并发症(术后尿瘘合并泌尿系感染), 另外10例患者为术后尿瘘3例、术后淋巴瘘2例、泌尿系统感染2例、下肢静脉血栓2例及术中输血1例, 未出现Clavien Ⅲ ~Ⅳ 级严重并发症。通过超高龄前列腺癌患者LRP术后的大体标本病理分析, 术后病理分期T2期者29例(56.9%), T3期者22例(43.1%), 其中包膜侵犯者18例(35.3%), 精囊侵犯者4例(7.8%); 大体病理Gleason评分6分、7分和≥ 8分者分别为8例(15.7%)、21例(41.1%)和22例(43.1%), 术后病理切缘阳性患者14例(27.5%)。
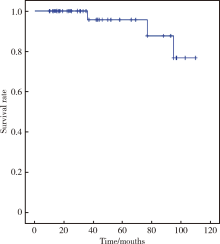
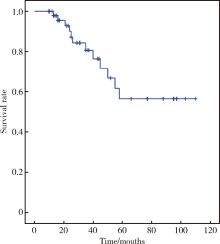
截止2017年10月, 术后随访10~118个月, 中位随访时间42个月, 术后3个月、6个月和1年超高龄前列腺癌患者行LRP术后的尿控率分别为64.7%(33/51)、82.4%(42/51)和 92.2%(47/51), 其中术后3个月发生严重尿失禁3例(5.9%), 术后6个月发生严重尿失禁1例(2.0%), 术后1年无严重尿失禁者。在随访过程中, 12例(23.5%)超高龄前列腺癌患者LRP术后出现生化复发(表1), 平均生化复发时间为40.9个月; 4例(7.8%)患者在随访过程中死亡, 其中1例(2.0%)患者因前列腺癌进展死亡, 3例(5.9%)患者因其他疾病死亡, 死亡原因分别为心肌梗死、呼吸衰竭和脑血管病。超高龄前列腺癌患者经LRP治疗后的无生化复发生存率和总体生存率Kaplan-Meier生存曲线见图1、2。经多因素COX回归分析, 影响超高龄前列腺癌患者术后生化复发的危险因素为PSA(P =0.019)、病理分期≥ T3期(P =0.017)和切缘阳性(P =0.030)。
| 表1 影响超高龄前列腺癌患者LRP术后生化复发的COX回归多因素分析 Table 1 Univariable and multivariable analysis of risk factors of biochemical regression after LRP in 80 years old or older patients |
 | 图1 超高龄前列腺癌患者LRP术后无生化复发生存率Kaplan-Meier生存曲线Figure 1 No biochemical regression survival rate Kaplan-Meier survival curve after LRP in 80 years old or older patients |
前列腺癌是老年男性最常见的恶性肿瘤之一, 近年来我国前列腺癌的发病率呈显著增长的趋势[1]。LRP是治疗局限性前列腺癌的标准术式, 目前国内外前列腺癌诊疗指南虽未对施行LRP的年龄作硬性限制, 但是, 预期寿命是局限性前列腺癌患者选择初始治疗的决定因素之一, 对预期寿命≥ 10年的局限性前列腺癌患者建议施行前列腺根治性切除术[2, 3]。
一项来自加拿大的统计显示[5], 80岁的老人平均预期寿命达8.1年, 而85岁的老人平均预期寿命降至6年; 在80岁的老人中, 身体情况最佳的四分之一人群的平均预期寿命为12.15年, 世界范围内高龄老人的预期寿命逐渐延长是必然趋势。随着我国老龄化进程逐渐加剧, 越来越多的高龄前列腺癌患者被检出, 虽然目前缺乏针对高龄前列腺癌患者有效的预期寿命计算模型以及国人在预期寿命方面的数据, 但不可否认的是, 80岁以上的前列腺癌患者确有部分有预期寿命大于10年的[6]。
对于≥ 80岁患者行LRP治疗的围手术期参数、控尿功能恢复和肿瘤学预后, 目前国外仅有少数样本量较小的回顾性研究[5, 6, 7], 尚未见针对中国人群超高龄前列腺癌患者接受腹腔镜前列腺癌根治术预后的相关临床研究。本研究回顾性分析北京大学第三医院2007年至2016年收治的超高龄前列腺癌患者的围手术期参数及术后随访情况, 拟探讨中国人群超高龄前列腺癌患者接受LRP治疗的安全性和有效性。
本研究行LRP手术的前列腺癌患者多为80~81岁(60.8%)年龄段患者, 无大于85岁者。对于80岁以上年龄段, 随年龄增长预期寿命明显下降, 患者合并症逐渐增多, 围手术期风险增加, 患者接受手术治疗的临床受益不明确, 故国外相关文献报道极少见对年龄大于85岁的前列腺癌患者施行外科手术治疗[5]。超高龄前列腺癌患者接受LRP应经过充分的临床评估并提示患者可能在LRP手术中获益。目前, 越来越多的临床证据表明前列腺根治性切除术作为初始治疗可使进展期及中高分级前列腺癌患者受益[8, 9]。本研究有72.5%的中高分级(穿刺Gleason评分≥ 7分)及27.5%的局部晚期(临床分期≥ T3期)前列腺癌患者, 并且LRP术后存在病理升级和分期升级, 术后大体病理提示本组患者中高分级前列腺癌占 84.2%, 病理分期为T3期者占比43.1%, 对于此类患者若无明显合并症或预期寿命≥ 10年, 应接受LRP并可能从手术治疗中获益。Dindo等[4]报道年龄≥ 80岁接受LRP的患者人群中, 中高分级前列腺癌占84%, 其中高分级前列腺癌(Gleason评分≥ 8分)达53%, 该作者认为肿瘤恶性程度高是泌尿外科医师和超高龄患者选择LRP手术的重要原因。另外, Mandel等[10]报道高龄(≥ 75岁)前列腺癌接受前列腺根治性切除术的患者中, 术后大体病理Gleason评分≥ 7者达 95.4%。从目前的临床指南来看, 对于低危型前列腺癌可采用动态监测等相对保守的治疗方法, 但是Rice等[11]报道针对高龄临床低危型前列腺癌患者, 相对于主动监测, 前列腺根治性切除术和外放疗均能改善患者的远期预后。所以, LRP作为高龄和超高龄前列腺癌患者的初始治疗仍具有重要意义, 高龄和超高龄并非施行LRP的绝对禁忌证, 但通过对患者的预期寿命和手术风险进行评估, 以选择恰当的患者施行手术非常重要。
本研究所有患者均完成手术, 11例患者发生围手术期并发症, 其中1例患者发生两种并发症(术后尿瘘合并泌尿系感染), 另外10例患者为术后尿瘘3例、术后淋巴瘘2例、泌尿系统感染2例、下肢静脉血栓2例及术中输血1例, 围手术期并发症发生率为21.6%, 且均为Clavien分级Ⅰ ~Ⅱ 级并发症, 未出现术后需介入治疗、外科手术甚至死亡者。但是, 超高龄患者手术耐受性差, 合并症较多, 所以围手术期并发症发生率较本课题组的前期报道有所增加[12]; Alibhai等[13]报道针对高龄前列腺癌患者前列腺根治性切除术后30 d内发生围手术期并发症比例为26.9%, 围手术期死亡率为0.66%, 明显高于70岁以下的前列腺癌患者; Begg等[14]亦报道对于年龄≥ 75岁的前列腺癌患者术后围手术期并发症发生率为35%, 围手术期死亡率为0.9%, 明显高于其他年龄段。所以, 超高龄患者施行LRP术后围手术期并发症发生率较高, 应在临床工作中予以重视。
本研究的术后平均随访时间为45.9个月, 在随访过程中, 12例(23.5%)超高龄前列腺癌患者LRP术后出现生化复发, 平均生化复发时间为40.9个月, 仅1例患者因前列腺癌进展死亡, 肿瘤控制情况较为满意, 但同时注意到, 本组患者中非肿瘤致死率较高(5.9%), 可能与患者年龄较高有关, 其死亡原因均为循环系统、呼吸系统等内科疾病。经多因素COX回归分析, 影响超高龄前列腺癌患者术后生化复发的危险因素为高PSA水平、病理分期≥ T3期和切缘阳性, 考虑高Gleason评分未能成为危险因素, 可能与本组病例中高分级前列腺癌例数过多有关, 但由于随访时间较短, 此结果仍需延长随访时间进一步确认; 而对于高PSA水平、局部晚期前列腺癌及切缘阳性者, 术后出现生化复发危险性明显增加, 必要时可予适当的辅助治疗改善远期预后。Mandel等[10]报道患者高龄本身即为术后生化复发的独立危险因素, 这可能与高龄患者肿瘤分期相对较晚及切缘阳性率高有关; 同时, Kim等[15]报道年龄≥ 70岁是LRP术后病理分期为局部晚期前列腺癌以及术后生化复发的独立危险因素, 以上研究均提示高龄前列腺癌患者本身肿瘤分期较晚, 术后出现生化复发的危险性较高, 应根据病理结果进行相应的辅助治疗并进行密切随访。
尿失禁是LRP术后最主要的远期并发症之一, 严重影响患者的生活质量。本研究所有超高龄患者行LRP术后3个月、6个月和1年的尿控率分别为 64.7%(33/51)、82.4%(42/51)和 92.2%(47/51), 术后1年无严重尿失禁者。本研究患者的早期控尿功能恢复相对较差, 但1年总体控尿率与本课题组前期报道相似[16], 可能与高龄患者手术耐受性较差, 控尿功能延迟恢复有关。Shikanov等[17]研究提示年龄是前列腺根治性切除术术后控尿功能延迟恢复的独立危险因素。所以, 对于超高龄前列腺癌患者施行LRP, 应充分向患者及家属交代术后可能出现控尿功能延迟恢复的风险。
本研究存在若干局限性, 首先本研究为回顾性分析, 时间跨度较大, 在此过程中国内外指南及手术技术均出现较大变化; 其次研究样本量相对较小, 超高龄前列腺癌患者行LRP手术相对少见, 病例选取易出现偏倚; 本研究随访时间相对较短, 大部分患者仍未达临床观察终点。所以本研究的结论仍需大样本量的前瞻性临床研究证实, 下一步应设计随机对照研究充分评估动态监测、外放射治疗、单纯内分泌治疗及前列腺根治性切除术对超高龄前列腺癌患者治疗的临床意义。
综上所述, 对于选择恰当的超高龄前列腺癌患者施行腹腔镜前列腺根治性切除术是可行的, 并且远期肿瘤控制情况良好, 高PSA水平、病理分期≥ T3期和切缘阳性是超高龄前列腺癌患者术后生化复发的独立危险因素, 但此结论尚需大样本量的前瞻性临床研究证实。
(本文编辑:王 蕾)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|