目的: 分析非人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染肺隐球菌病的临床特点,提高临床医生对本病的认识,减少误诊和漏诊。方法: 回顾性分析1997年6月至2016年6月在北京大学第一医院住院治疗的非HIV感染肺隐球菌病患者的临床表现、影像学特征、实验室检查、治疗及预后。结果: 共收集非HIV感染肺隐球菌病病例34例,其中男22例,女12例,年龄20~75岁,平均(50.1±15.0)岁,包括存在宿主因素和(或)基础疾病的免疫损害患者16例。67.6%患者因症状就诊,常见症状依次为咳嗽、发热、胸痛、憋气、咯血,32.4%患者没有任何症状。常见胸部影像学表现为斑片、实变影及结节团块影。20例行隐球菌荚膜多糖抗原检测,19例阳性。11例行腰椎穿刺术脑脊液检查,3例合并中枢神经系统隐球菌感染。24例患者初诊时被误诊,其中11例误诊为肺癌。经皮肺穿刺活体组织检查确诊15例,经手术确诊11例,临床诊断8例。手术切除治疗11例,中位随访4年,1例复发。药物抗真菌治疗23例,中位随访8年,3例失访,1例复发。与免疫正常组相比,免疫损害组患者年龄更高( P=0.017)、肺部湿啰音更多( P=0.006)、外周血白细胞或中性粒细胞百分比升高者更多( P=0.003),但在症状、肺部影像特点及住院时间方面无明显差异。结论: 非HIV感染肺隐球菌病的临床症状、体征没有特异性,诊断依靠组织病理检查,临床高度怀疑的患者应首选经皮肺穿刺活体组织检查。隐球菌荚膜多糖抗原检测的灵敏度高,检测阳性有临床疑似诊断价值。规范抗真菌治疗是肺隐球菌病的主要治疗方法,大多数患者预后良好。
Objective: To improve the understanding of the clinical features of pulmonary cryptococcosis in non-human immunodeficiency virus (non-HIV) infection patients and reduce delay in diagnosis, or misdiagnosis.Methods: The clinical features, imaging characteristics, laboratory examinations, treatment and prognosis of 34 cases of pulmonary cryptococcosis were retrospectively analyzed. The data were collected from Peking University First Hospital from June 1997 to June 2016.Results: There were 34 cases diagnosed with pulmonary cryptococcosis, including 22 males and 12 females, aged from 20 to 75 years [average: (50.1±15.0) years]. There were 16 cases with host factors and (or) underlying diseases named immunocompromised group. In the study, 67.6% patients had clinical symptoms while 32.4% patients had no symptoms. The most common symptoms included cough, fever, chest pain, shortness of breath, and hemoptysis in sequence. Common chest imaging findings were patchy infiltrates, consolidation, single or multiple nodular or masses shadows. Among the 20 cases with cryptococcal capsular polysaccharide antigen detection, 19 were positive. Eleven cases underwent routine cerebrospinal fluid examination, and 3 cases complicated with central nervous system cryptococcal infection. At first visit, 24 cases were misdiagnosed, among which, 11 cases were misdiagnosed as lung cancer. The diagnosis of 15 cases was proved by percutaneous lung biopsy and 11 were confirmed by surgery, while 8 were diagnosed clinically. Then 11 cases were treated by surgical resection, and in median 4 years’ follow-up, there was 1 case of recurrence. And 23 cases were treated with antifungal therapy, and in median 8 years’ follow-up, 3 cases lost to the follow-up and 1 case of recurrence. Compared with normal immune group, immunocompromised patients had higher ages ( P=0.017), more crackles ( P=0.006) and more percentage of increase of peripheral white blood cells or neutrophils ( P=0.003), but no significant difference in symptoms, imaging characteristics or hospitalization time.Conclusion: There were no specific clinical symptoms and signs for pulmonary cryptococcosis in non-HIV patients. Diagnosis of pulmonary cryptococcosis depends on pathology. Percutaneous lung biopsy was mostly recommended for clinical highly suspected patients. Cryptoeoccal capsular polysaccharide antigen detection had a high sensitivity for the clinical diagnosis. Antifungal drug therapy was the major treatment, and the prognosis of the most patients was good.
肺隐球菌病是由隐球菌感染引起的急性、亚急性或慢性肺部真菌感染。近年来, 隐球菌病的发病率呈上升趋势, 已成为仅次于白色念珠菌和曲霉的第三大类肺真菌病, 日益受到临床关注[1, 2]。隐球菌病的临床表现缺乏特异性, 较难与细菌性肺炎、肺结核和肺部肿瘤等相鉴别, 容易误诊[3]。本研究回顾性分析了34例非人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染肺隐球菌病患者的临床资料, 旨在进一步提高对肺隐球菌病临床特点的认识, 减少误诊、漏诊。
选取1997年6月至2016年6月在北京大学第一医院住院治疗的非HIV感染肺隐球菌病患者34例。诊断标准参照《隐球菌病处理临床实践指南(2010年美国感染病学会更新)》[4]及2010年中国《隐球菌感染诊治专家共识》[5]等。
回顾性分析非HIV感染肺隐球菌病患者的临床资料, 随访患者并对比不同免疫状态下肺隐球菌病的临床特点。
采用SPSS 14.0统计软件进行统计学分析, 计量资料以均数± 标准差表示, 组间比较采用独立样本t检验; 计数资料以例数或百分比进行描述, 组间比较采用Fish精确概率法χ 2检验, P< 0.05为差异有统计学意义。
34例患者中, 男22例, 女12例, 年龄20~75岁, 平均(50.1± 15.0)岁。16例患者存在宿主因素和(或)基础疾病, 设为免疫损害组, 包括持续应用激素> 3个月6例, 器官移植后接受免疫抑制治疗3例, 2型糖尿病3例, 类固醇性糖尿病1例, 免疫抑制治疗+糖尿病2例, 恶性肿瘤1例。不存在上述情况的患者设为免疫正常组, 共18例。免疫损害组患者的年龄[(56.5± 12.1)岁]高于免疫正常组[(44.4± 15.3)岁, P=0.017]。两组患者在性别、住院时间、合并中枢神经系统感染方面差异无统计学意义。
67.6%的患者因症状就诊, 常见症状依次为咳嗽、发热、胸痛、憋气、咯血。32.4%的患者没有任何症状, 仅在体检时发现肺部阴影, 这部分患者大多首诊于胸外科, 疑诊肺恶性肿瘤而行手术治疗。70.6%的患者就诊时没有特殊肺部体征, 部分患者可出现湿啰音, 有肺部实变及胸腔积液的患者可出现呼吸音减低。合并中枢神经系统感染的有3例患者, 1例表现为间断头痛、恶心、呕吐, 另2例无神经系统症状, 而在行脑脊液检查后得以诊断。患者的具体症状分布见表1。免疫损害组患者更多出现肺部湿啰音(P=0.006), 而其余症状和体征两组相比差异无统计学意义。
| 表1 两组患者的症状和体征分布 Table 1 Distribution of clinical symptoms and signs of the two groups |
免疫损害组的16例患者中, 外周血白细胞或中性粒细胞百分比升高者10例, 而免疫正常组的18例患者中仅2例升高, 两组差异有统计学意义(P=0.003)。部分患者出现红细胞沉降率(erythrocyte sedimentation rate, ESR)和C-反应蛋白(C-reactive protein, CRP)升高。12例患者检测了血(1, 3)-β -D葡聚糖(简称G试验)和半乳甘露聚糖(简称GM试验), 其中4例G试验阴性、GM试验阳性, 其余8例G试验和GM试验均阴性。免疫损害组的5例患者检测了外周血C
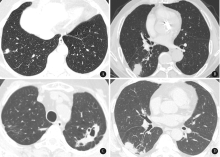
肺隐球菌病患者的肺CT影像大多数表现为斑片、实变影及结节团块影, 多叶分布, 部分伴有空洞和支气管气相, 约1/4的患者累及胸膜。两组患者在肺部病变特点、叶段分布方面均无显著差异(表2)。肺隐球菌病的典型胸部CT表现为右肺下叶外基底段软组织结节, 分叶状, 可见毛刺及胸膜牵拉(图1A); 右肺下叶背段软组织占位, 形态不规则, 可见分叶及毛刺(图1B); 左肺上叶尖后段不规则软组织占位, 可见支气管气相及多发空洞, 长毛刺(图1C); 右肺下叶背段多发软组织密度结节, 部分融合, 其内可见空泡, 周围见毛刺, 相邻胸膜增厚改变(图1D)。
| 表2 两组患者胸部CT影像表现的比较 Table 2 Distribution of chest CT findings of the two groups |
26例患者经组织病理检查确诊, 其中11例为手术切除的组织病理检查, 15例为CT或B超引导下肺穿刺活体组织病理检查, 肺隐球菌病的典型组织病理表现为肺组织部分区域肺泡结构破坏, 代之以增生的纤维组织, 其内见多量肉芽肿(图2A); 肉芽肿由上皮样组织细胞和多核巨细胞组成, 多核巨细胞内可见直径4~7 μ m的圆形病原体, 荚膜淡红染, 中心不着色(图2B); 多核巨细胞内见黑色病原体(图2C); 多核巨细胞内见红染的病原体(图2D)。
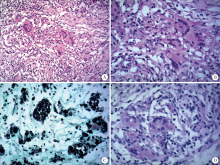 | 图2 肺隐球菌病的组织病理检查Figure 2 Histopathologic findings of pulmonary cryptococcosisA, HE stain × 200; B, HE stain × 400; C, GMS stain × 400; D, PAS stain × 400. |
8例患者临床诊断均为血隐球菌抗原阳性, 其中3例肺泡灌洗液或胸水中培养出隐球菌。20例患者进行了血隐球菌抗原检测, 19例阳性, 阴性的1例患者无宿主因素, 为仓库管理员, 经常接触潮湿环境, 无临床症状, CT表现为右肺下叶背段多发斑片影, 经CT引导下肺穿刺活体组织病理诊断。首诊胸外科的11例患者均未行隐球菌抗原检测。15例患者进行了纤维支气管镜检查, 绝大部分镜下未见明显异常, 12例经支气管透壁肺活体组织病理检查均仅提示慢性炎症, 难以明确诊断。24例患者初诊时被误诊, 其中11例患者初诊为肺癌, 4例初诊为肺结核, 7例初诊为肺炎, 1例初诊为血管炎, 1例初诊为机化性肺炎。
11例患者行手术治疗, 其中6例行病变局部切除, 5例行肺叶切除, 其中3例患者术后口服氟康唑2~6个月。手术患者的中位随访时间为4年, 1例肾移植免疫抑制治疗的患者术后2年化验血隐球菌抗原阳性, 规律抗真菌治疗6个月后转阴, 其余未见复发病例。23例患者采用氟康唑抗真菌治疗, 5例联合两性霉素B或两性霉素B脂质体治疗, 其中3例为合并中枢神经系统隐球菌感染。氟康唑的剂量为0.2~0.4 g/d, 疗程3个月至1年, 中位随访时间8年, 3例患者失访, 18例患者病变基本吸收, 未再复发, 1例病变缩小, 长期稳定, 1例合并曲霉菌感染, 换用伊曲康唑治疗, 停药后疾病反复, 自行长期用药。合并中枢神经系统感染的3例患者中1例失访, 另2例抗真菌治疗1年, 均治愈。
隐球菌广泛分布于自然界的土壤及禽粪中, 没有荚膜, 易形成气溶胶, 可经呼吸道吸入到达肺泡, 引起肺隐球菌病。肺隐球菌病以往被认为是一种少见病, 且大多好发于免疫抑制患者, 近年来其发病率呈上升趋势, 尤其是非HIV患者中的报道日渐增多[6], 本研究中52.9%的患者没有任何宿主因素。肺隐球菌病的症状缺乏特异性, 容易误诊和漏诊[7], 本研究中32.4%的患者无症状, 67.6%的患者因咳嗽、发热、胸痛、憋气、咯血等症状就诊, 与以往文献报道[8]相似。24例(70.6%)患者首诊被误诊为肺癌、肺结核、肺炎等其他疾病, 接受了不必要的手术治疗、抗结核药物或抗生素的治疗, 因此, 肺隐球菌病应该纳入肺部阴影鉴别诊断常规要考虑的疾病。
隐球菌病由呼吸道吸入而感染, 一般认为免疫正常患者的病灶多局限, 免疫抑制患者的病灶多散在分布。日本的一项研究发现肺部病灶多分布在外周, 尤以右肺下叶多见, 病灶形态主要为结节团块型, 有基础疾病的患者更多见右肺中叶实变、病灶多叶分布以及支气管气相[9]。我们的病例中, 从症状和体征来看, 免疫损害组的患者更多出现肺部湿啰音(P=0.006), 提示免疫损害的患者更多出现渗出性病变。本研究两组患者在肺部病变特点、肺叶分布方面差异均无统计学意义, 且均未出现单一累及中叶的病灶, 与以往文献报道不完全一致, 可能与病例数偏少有关, 有待更大样本的研究证实。
在肺隐球菌病的诊断方面, 痰涂片、痰培养和血培养的隐球菌检出率极低, 支气管镜检查的阳性率也不到10%[10], 由于肺隐球菌病灶多分布在外周, 适合经皮肺穿刺活体组织检查来明确诊断。我们的病例中, 12例经支气管透壁肺活体组织检查均未能明确诊断。组织病理确诊的26例患者中, 15例经皮肺穿刺明确诊断。CT引导下经皮肺穿刺活体组织检查是一种安全、快捷、准确的诊断方法[11, 12], 因此, 临床高度怀疑肺隐球菌病的患者应首选经皮肺穿刺活体组织检查, 避免不必要的开胸手术。肺部病灶局限而内科治疗效果不佳的患者, 方可考虑手术治疗。
乳胶凝集试验检测隐球菌荚膜多糖抗原已成为临床上常用的检测方法, 可检测血液、脑脊液、胸腔积液、痰液及肺支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)等标本, 以往文献报道乳胶凝集试验的敏感度高达93%以上[13, 14]。本组病例中, 隐球菌抗原诊断肺隐球菌病的阳性率是95%, 与以往文献报道相似。血清乳胶凝集试验阳性, 结合临床和典型的影像学表现, 可以临床诊断肺隐球菌病。首诊胸外科的患者如能进行隐球菌抗原检测诊断, 则可以避免不必要的开胸手术, 但隐球菌抗原检测阴性并不能作为排除隐球菌病诊断的依据, 如果临床及影像学高度怀疑, 需进一步取得组织病理诊断。
G试验和GM试验是诊断真菌感染的重要检查。新型隐球菌细胞壁中含有(1, 3)-β -D葡聚糖, 因外面包裹了一层厚荚膜, 很难将(1, 3)-β -D葡聚糖释放到血液中, 所以G试验为阴性[15]。同时, 新型隐球菌荚膜抗原和曲霉半乳糖甘露聚糖具有交叉抗原性[16], 当血中出现高滴度隐球菌荚膜抗原时, GM试验可出现阳性。也就是说, 隐球菌感染可以表现为G试验阴性而GM试验阳性。本组病例中, GM试验的阳性率是33.3%(4/12), G试验均阴性, 因此, 在不能检测隐球菌抗原的情况下, G试验阴性而GM试验阳性对隐球菌感染有一定提示意义。
《隐球菌感染诊治专家共识》[5]指出, HIV阴性患者隐球菌肺部感染(除无症状、非弥漫性病变的免疫正常宿主, 且血清隐球菌抗原阴性或低滴度者外)及肺外隐球菌病的患者均建议进行腰椎穿刺检查以排除伴发中枢神经系统感染的可能。本组病例中仅32.4% (11/34)的患者进行了腰椎穿刺检查, 阳性率为27.3%(3/11)。需要指出的是, 腰椎穿刺检查阳性的3例患者中仅1例有间断头痛、恶心、呕吐等中枢神经系统症状。鉴于中枢神经系统是隐球菌最常见的感染部位, 对于肺部隐球菌感染, 即使没有神经系统症状也需要进行腰椎穿刺脑脊液检查以除外合并中枢神经系统隐球菌感染。
外科治疗的肺隐球菌病, 术后是否继续抗真菌治疗目前尚存在争议。有人认为手术治疗术后隐球菌脑膜炎的发生率较高[10], 《隐球菌感染诊治专家共识》[5]也建议术后常规应用抗真菌药治疗, 疗程至少2个月, 但也有研究认为手术切除彻底者可以不用抗真菌治疗[17]。本组外科手术治疗后未行抗真菌治疗者8例, 5例为病灶局部切除, 3例为肺叶切除。复发的病例为病灶局部切除的肾移植免疫抑制治疗患者。因此, 我们认为对于存在免疫损害或者病变切除不彻底的肺隐球菌病患者, 术后应该进行2个月以上的抗真菌治疗。
综上, 肺隐球菌病起病隐匿, 临床症状、体征没有特异性, 应该纳入肺部阴影鉴别诊断常规要考虑的疾病中。肺隐球菌病的诊断依靠组织病理, 临床高度怀疑的患者应首选经皮肺穿刺活体组织检查。隐球菌荚膜多糖抗原检测的灵敏度高, 检测阳性有临床疑似诊断价值。抗真菌治疗是肺隐球菌病的基础治疗, 大多数患者预后良好。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|