目的: 以人脂肪来源干细胞(human adipose-derived stem cells,hASCs)作为种子细胞,通过三维生物打印构建hASCs共混物打印体,以低能量激光为刺激手段,探索低能量激光照射(low level laser irradiation,LLLI)对三维结构成骨能力的影响。方法: 制备hASCs/海藻酸钠/明胶三维生物打印体,并随机分为4组:增殖培养基(proliferative medium,PM)组、PM+LLLI组、成骨培养基(osteogenic medium,OM)组、OM+LLLI组,激光照射总能量密度为4 J/cm2。通过肉眼及倒置相差显微镜对打印体进行观察并拍照;用Live/Dead染色评价打印体内细胞存活率;利用免疫荧光染色比较各组成骨向分化因子骨钙素(osteocalcin,OCN)及 Runt相关转录因子2(Runt-related transcription factor 2,Runx2)的表达。结果: 获得规格10 mm×10 mm×1.5 mm、半透明、网格状的三维结构体,微丝宽度约为1 mm,孔隙呈圆形,直径在700 μm左右。打印体内细胞存活率较高,且各组间无明显差异。第7天时,OCN的表达量从高到低依次为OM+LLLI组、PM+LLLI组、OM组、PM组,除PM+LLLI组与OM组间差异无统计学意义外,其他各组间差异均有统计学意义( P<0.01)。到了第14天时,各组OCN表达量较第7天均有不同程度增高,OM+LLLI与OM组间差异不再有统计学意义。Runx2表达量方面,OM+LLLI组在第7天时即达到90%以上,显著高于OM组( P<0.01),PM+LLLI 组也显著高于PM组( P<0.05);而到第14天,PM+LLLI组及OM+LLLI组的Runx2表达量又明显降低至低于相应未照射组。故OCN及Runx2表达量上,成骨诱导培养组明显高于未成骨诱导组,经低能量激光照射组明显高于未照射组,随着培养时间的延长,这种差异逐渐减小。结论: LLLI不会对hASCs/海藻酸钠/明胶三维生物打印体内hASCs存活率造成影响,且可促进hASCs成骨向分化。
Objective: To explore the effects of low level laser irradiation (LLLI) on the osteogenic capacity of three-dimensional (3D) structure by 3D bio-printing construct used human adipose-derived stem cells (hASCs) as seed cells.Methods: Using hASCs as seed cells, we prepared sodium alginate/gelatin/hASCs 3D bio-printing construct, and divided them into four groups: PM (proliferative medium), PM+LLLI, OM (osteogenic medium) and OM+LLLI, and the total doses of LLLI was 4 J/cm2. Immunofluorescence microscopy was used to observe the viability of the cells, and analyze the expression of the osteogenesis-related protein Runt-related transcription factor 2 (Runx2) and osteocalcin (OCN).Results: The 3D constructs obtained by printing were examined by microscope. The sizes of these 3D constructs were 10 mm×10 mm×1.5 mm. The wall thickness of the printed gelatin mold was approximately 1 mm, and the pores were round and had a diameter of about 700 μm. The cell viability of sodium alginate/gelatin/hASCs 3D bio-printing construct was high, and the difference among the four groups was not significant. On day 7, the expression of OCN from high to low was group OM+LLLI, PM+LLLI, OM and PM. There were significant differences among these groups ( P<0.01), but there was no significant difference between group PM+LLLI and OM. On day 14, the expression of OCN in each group was hi-gher than that on day 7, and there was no significant difference between group OM+LLLI and OM. The expression of Runx2 in group OM+LLLI was more than 90%, significantly higher than that in group OM ( P<0.01). But the expression of Runx2 in group PM+LLLI and OM+LLLI were significantly lower than that in the non-irradiated groups. The expression of osteogenesis-related protein Runx2 and OCN were higher in OM groups than in PM groups. Furthermore, the irradiated groups were significantly higher than the non-irradiated groups.Conclusion: LLLI does not affect the cell viability of sodium alginate/gelatin/hASCs 3D bio-printing construct, and may promote the osteogenic differentiation of hASCs.
单层细胞培养是体外细胞培养的主要方法, 它具有培养简单、易操作、费用低、可大量应用的优点。然而, 用来培养细胞的培养瓶或培养皿不能代表实际的组织和器官, 因为这种单一的二维培养方式无法模拟细胞间错综复杂的结构关系。细胞附在底物平面上生长, 因缺少立体支架而只能向二维发展, 不能生成细胞外基质, 从而失去了组织特异性结构、机械和生物化学线索以及细胞间信息传递等讯息[1]。
随着组织工程技术的飞速发展, 越来越多的学者通过构建三维结构模型来模拟细胞在体内的生存环境。Abramovitch-Gottlib等[2]将骨髓间充质干细胞接种到三维生物材料表面, 发现激光照射组比未照射组有更多的新生骨形成。Choi等[3]发现将脂肪间充质干细胞接种到脱细胞真皮基质中获得的复合体植入动物体内, 能够促进骨再生, 且如果辅助低能量激光照射(low level laser irradiation, LLLI), 这种促进作用会更加明显。
三维生物打印作为一门新兴技术, 有着不容小觑的发展潜力, 与传统组织工程比较, 其具有复杂三维体结构的高精度定位、精确定量快速成型、可多种细胞同时打印且高效自动化制造等优点[4], 因而有望更真实地模拟体内微环境。本课题组在前期研究中发现人脂肪来源干细胞(human adipose-derived stem cells, hASCs)/海藻酸钠/明胶三维生物打印可以在体内成骨[5]。虽然现在关于三维生物打印体成骨能力方面的研究越来越多, 但LLLI对这种特殊生物结构的作用方面仍是空白。
本课题组前期研究观察到LLLI具有促进hASCs增殖及成骨向分化的作用, 且发现激光照射剂量与刺激作用强弱之间存在规律[6], 在此基础上, 本研究将探索LLLI对三维生物打印体成骨能力的影响, 为LLLI在组织工程中的应用开拓新的方向。
实验用主要设备如下:激光发生器(A.R.C, 德国)、激光功率测量仪(OPHIR, 以色列)、三维生物打印机(Envision TEC, 德国)、激光共聚焦显微镜(Carl Zeiss, 德国), 实验所用软件为Image pro plus 6.0(MediaCybernetics, 美国)。
人脂肪间充质干细胞细胞株购自美国ScienCell公司, 成骨向分化诱导因子β -甘油-2-磷酸二钠盐水合物、抗坏血酸、地塞米松、海藻酸钠、明胶、无水CaCl2以及TritonTM X-100均购自美国Sigma公司, DMEM(Dulbecco’ s modified Eagle’ s medium)培养基、胎牛血清、100× 细胞培养用青链霉素混合液均购自美国Gibco公司, 氯化钠注射液购自中国双鹤药业, 钙黄绿素-AM及碘化丙啶购自日本DOJINDO公司, 抗骨钙素(osteocalcin, OCN)抗体及抗Runt相关转录因子2(Runt-related transcription factor 2, Runx2)抗体购自英国Abcam公司, 细胞培养皿等耗材购自美国Corning公司。
1.3.1 搭建低能量激光实验平台 本实验采用了半导体激光器, 波长为980 nm, 输出功率为100 mW至12 W。将光纤置于暗盒中, 激光光束从暗盒下方的圆孔中发出, 使得光斑呈规则圆形。照射时, 将培养皿盖打开, 并在培养皿下方垫以不透光黑纸, 避免激光发生反射。通过调整光纤头至被照表面距离来调节光斑大小, 使得光斑刚好能够覆盖被照物表面。照射过程在生物安全柜中进行, 避免细菌污染。用激光功率测量仪(OPHIR, 以色列)测量被照表面实际接收功率, 得出功率密度。照射时间的计算方法为:照射时间(s)=能量密度(J/cm2)/功率密度(W/cm2)。
1.3.2 细胞培养及传代 将P0代hASCs加入增殖培养基, 培养基成分为DMEM+10%(体积分数)胎牛血清+1%(体积分数)青链霉素, 置于含5%(体积分数)二氧化碳、95%(体积分数)氧气的37 ℃恒温培养箱中进行培养。培养至7 d左右, 细胞生长至70%~80%汇合状态后, 进行细胞传代, 每个培养皿中的细胞经过胰酶消化、中和、离心和重悬后, 接种至3个培养皿中, 每5~7天汇合度达到80%~90%后, 再次进行传代; 传代4次后的hASCs标记为P4代作为实验所用种子细胞。
1.3.3 hASCs/海藻酸钠/明胶共混物的制备 称取海藻酸钠粉末0.33 g、明胶干粉0.6 g, 置于打印机配套的储料管中。室温下, 向储料管中加入5 mL生理盐水, 搅拌均匀, 封口置于37 ℃恒温培养箱内过夜。将处于对数生长期的种子细胞悬液与海藻酸钠-明胶水溶胶材料混合, 轻柔混匀, 获得hASCs/海藻酸钠/明胶水溶胶的共混物。混合物中海藻酸钠的终浓度均为20 g/L, 明胶的终浓度均为80 g/L, 即海藻酸钠与明胶的浓度比为1 :4, hASCs的密度为3× 106个/mL。共混物置于37 ℃恒温培养箱中备用。
1.3.4 三维结构体的设计与打印 使用三维生物打印机(Envision公司, 德国)的系统设计软件, 进行三维生物打印蓝图的CAD建模, 每层为边长10 mm的正方形, 各层打印丝较第一层夹角为90° 和0° 交替变化, 打印丝间距为1.5 mm(图1)。将三维生物打印机的成型室及打印所用耗材用紫外光照射45 min灭菌, 将储料盒温度设置为37 ℃, 成型室温度设置为4 ℃, 在储料管下端拧上直径为300 μ m的针头, 在成型室中放置一直径6 cm的培养皿, 准备打印。由预先设计的具有层片信息的CAD模型及选定的成形参数, 直接驱动打印机的喷头运动, 将共混物均匀地喷出到培养皿中。挤出的共混物因明胶的温度敏感性发生物理交联, 由溶胶转变成凝胶。待一层打印完成后, 立即用200 mmol/L的CaCl2溶液交联, 加入增殖培养基, 放入37 ℃培养箱中培养。
肉眼观察三维结构体的外形, 拍照记录。用倒置相差显微镜对三维结构体进行观察并拍照。
将打印体分为4组:增殖培养基(proliferative medium, PM)组、PM+LLLI组、成骨培养基(osteogenic medium, OM)组、OM+LLLI组。将打印体制备完成24 h后设置为第0天, 将OM、OM+LLLI两组打印体更换成骨培养基。PM+LLLI、OM+LLLI两组打印体于第0~3天连续激光照射4 d, 每天照射能量密度为1 J/cm2, 两次照射间隔24 h, 照射总能量密度为4 J/cm2。调节光斑直径与打印体对角线长度一致, 为1.4 cm, 光纤头至被照表面距离为6.0 cm(图2), 实验方案详见表1。
| 表1 hASCs/海藻酸钠/明胶三维生物打印体生物学性能检测的实验方案 Table 1 Experimental design about the biological performance of hASCs/alginate/gelatin 3D bio-printing construct |
1.4.1 Live/Dead染色 于第0天和第3天, 将各组打印体用含有5 μ mol/L钙黄绿素-AM和3 mol/L碘化丙啶的生理盐水, 在37 ℃、5%CO2、饱和湿度的细胞培养箱中孵育45 min。用激光共聚焦显微镜分别在488 nm(CAM激发波长)和543 nm(PI激发波长)的激发光下, 观察打印体内活、死细胞数目, 截取打印体上、中、下部3个层面, 保存所获图像。用Image pro plus 6.0软件分析图像, 对图像中的红、绿色光点进行计数(红色光点代表死细胞, 绿色光点代表活细胞), 计算各层面的细胞存活率, 取平均值, 得出各组打印体内hASCs的存活率。细胞存活率=[活细胞总数/(活细胞总数+死细胞总数)]× 100%。
1.4.2 OCN、Runx2免疫荧光染色 于第7天和第14天, 将打印体先后用40 g/L多聚甲醛室温固定10 min, 0.1%(体积分数)Triton X-100室温处理10 min, 用稀释后的一抗4 ℃孵育过夜。用磷酸盐缓冲液1 :500稀释二抗, 避光室温孵育1 h。用含DAPI的荧光封片液封片, 用激光共聚焦显微镜分别在488 nm(绿光)、543 nm(红光)及358 nm DAPI(蓝光)的激发光下, 观察各组打印体中细胞的OCN及Runx2的表达量差异, 截取并保存打印体上、中、下部3个层面图像。用Image pro plus 6.0 软件分析图像, 对图像中的红、绿、蓝色光点进行计数, 蓝色光点代表该层面所有细胞, 红、绿色光点分别代表表达Runx2及OCN的细胞, 计算Runx2及OCN的表达量。Runx2表达量=红色光点个数/蓝色光点个数; OCN表达量=绿色光点个数/蓝色光点个数。
采用SPSS 19.0软件进行统计学分析, 数值以均数± 标准差表示。采用单因素方差分析(ANO-VA)分别对各组打印体细胞存活率及Runx2、OCN表达量进行分析, 组间比较采用LSD检验, 如果数据方差不齐则采用秩和检验(Kruskal-Wallis H test), P< 0.05表示差异具有统计学意义。
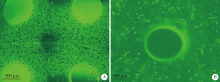
本实验通过三维生物打印技术, 将hASCs/海藻酸钠/明胶共混物制成大小为10 mm× 10 mm× 1.5 mm的、半透明的、网格状的三维结构体, 基本符合预先计算机辅助设计的结构(图3)。倒置相差显微镜下可见打印体微丝宽度约为1 mm, 孔隙呈圆形, 直径在700 μ m左右, 基质材料中hASCs呈圆球形, 密度较高, 呈均匀分布(图4)。
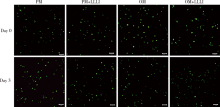
于第0天和第3天, 对各组打印体进行Live/Dead染色, 用激光共聚焦显微镜观察细胞存活情况, 结果显示各组打印体内细胞分布均匀, 大部分细胞存活, 呈绿色荧光, 仅少量零散分布的死细胞呈红色荧光(图5)。第0天时, 各组细胞存活率分别为:PM组92.31%± 1.88%, PM+LLLI组93.95%± 4.68%, OM组96.10%± 2.50%, OM+LLLI组95.33%± 2.61%。第3天时, 各组细胞存活率分别为PM组93.21%± 2.29%, PM+LLLI组93.15%± 2.15%, OM组95.89%± 0.08%, OM+LLLI组94.58%± 1.28%。各组打印体间及同组打印体不同培养天数间细胞存活率差异均无统计学意义。
于第7天和第14天, 对各组打印体进行OCN及Runx2免疫荧光染色, 以探索LLLI对打印体内hASCs成骨向分化的影响。免疫荧光染色图像显示各组打印体内蓝色光点分布均匀, 有不同程度的绿色或红色光点表达, 同组打印体上部、中部及下部的表达量无明显差异(图6、7)。用Image pro plus 6.0 软件分析图像, 对图像中的红、绿、蓝色光点进行计数。第7天时, OCN的表达量从高到低依次为OM+LLLI(85.24%± 7.07%)、PM+LLLI(63.78%± 8.28%)、OM(55.57%± 5.63%)、PM(27.5%± 6.23%), 除PM+LLLI与OM组间差异无统计学意义外, 其他各组间差异均有统计学意义(P< 0.01)。至第14天时, OCN的表达量为:PM组42.82%± 5.75%, PM+LLLI组73.51%± 2.84%, OM组84.18%± 4.53%, OM+LLLI组89.62%± 0.48%, 各组OCN表达量较第7天均有不同程度增高, OM+LLLI与OM组间差异不再有统计学意义。Runx2表达量在第7天时, PM组40.27%± 8.82%、PM+LLLI组57.39%± 10.07%、OM组51.21%± 7.66%、OM+LLLI组92.11%± 2.12%, OM+LLLI组在第7天时即达到90%以上, 显著高于OM组(P< 0.01), PM+LLLI组也显著高于PM组(P< 0.05); 而到第14天时, Runx2的表达量为:PM组53.92%± 7.29%、PM+LLLI组46.78%± 12.46%、OM组84.02%± 7.71%、OM+LLLI组62.05%± 4.34%, PM+LLLI组及OM+LLLI组的Runx2表达量又明显降低至低于相应未照射组(图8)。
生物支架是细胞黏附的基本框架, 是细胞增殖分化的基本场所。骨组织工程要求支架材料具有生物相容性、有成骨诱导能力且可以生物降解[7]。水凝胶是水溶性高分子通过一定的化学交联或物理交联形成的交联聚合物[8], 具有以下特点:如自然组织一样的高含水量、良好的生物相容性、力学性质柔软与软组织相似、能够高效输送养分和排泄代谢物、具有包裹细胞的强大能力, 这使得水凝胶被广泛地用于构建组织工程支架[9, 10]。本研究以海藻酸钠/明胶水溶胶为载体, 在打印前混入hASCs, 实现了细胞在三维结构体里的均匀分布。打印过程中, 微丝中的明胶水溶胶在低温成型室中转变为凝胶, 使结构体得以成形。后处理过程中, 结构体中的海藻酸钠溶胶与CaCl2溶液中的Ca2+发生化学交联, 转变为海藻酸钙凝胶, 使结构体的稳定性得以维持。虽然微丝在由溶胶变为凝胶的过程中发生了一定程度的塌陷, 使得实际的打印体空隙比预先设计的尺寸更小一些, 但仍然形成了内部具有相互连通空隙的三维立体结构, 有利于hASCs的新陈代谢。
三维生物打印后的细胞活性是评价细胞打印效果的一个重要指标, Live/Dead染色是判断细胞活性的一个常用方法[11, 12]。Live/Dead染色应用了CAM和PI两种典型的荧光指示染料, 其原理为:CAM扩散进入活细胞, 被胞内非特异性酯酶水解, 产物被波长为488 nm的激发光激发, 发射明亮的绿色荧光; PI扩散进入丧失膜完整性的细胞(死细胞), 与胞内DNA结合形成复合物, 该复合物被波长为543 nm的激发光激发, 发射红色荧光。在激光共聚焦显微镜下观察经双荧光染色的三维结构体, 结果显示不同培养天数、不同组间的细胞存活率无明显差异。这说明经过三维生物打印的hASCs有较高的存活率, 且不同的细胞培养基, 以及是否接受LLLI等因素不会对hASCs存活率造成影响。
本课题组以往研究表明, LLLI具有促进二维培养的hASCs增殖分化的作用, 且起到最大生物刺激效果的激光参数为4 J/cm2[6]。但LLLI不能单独作为一种成骨诱导的方式, 需配合成骨诱导培养才能发挥促干细胞成骨分化的作用。基于这个结论, 本部分实验利用三维生物打印机制成hASCs/海藻酸钠/明胶三维生物打印体, 探索LLLI是否对三维结构体也有类似的生物刺激作用, 并且设置成骨诱导组及非成骨诱导组, 探索LLLI是否要在成骨诱导培养的基础上才能发挥促成骨向分化的作用。
与细胞成骨向分化相关的基因包括Runx2、OCN、OSX和COL-1等, 其中Runx2为成骨分化早期的重要标志物[13], OCN、OSX为成骨向分化晚期的重要标记蛋白[14]。本研究选取成骨分化早期标志物Runx2, 以及晚期标志物OCN进行免疫荧光染色分析, 结果显示OM组的表达量明显高于PM组, 而PM+LLLI组的表达量与OM组间差异无统计学意义, 这一发现提示LLLI有望单独作为一种成骨诱导的方式。Abramovitch-Gottlib等[2]在研究中也有相似的发现, 即在没有任何其他成骨诱导方式的前提下, 三维生物基质结合LLLI可以促进体外成骨向分化。比较课题组以往研究的实验结果, LLLI对三维结构起到的生物刺激作用比对二维培养的细胞更为明显, 其原因可能为:一方面多孔隙的三维结构为细胞提供了更为充足的生长空间, 且这种生物基质材料的表面更适宜细胞的粘附和增殖; 另一方面, LLLI可以加快细胞内和细胞间的信号传递速度[15], 而三维结构为细胞提供了建立信号传递网络的空间。
Runx2是转录因子Runxx家族成员之一, 作为成骨细胞的特异转录因子, 对骨组织的形成和重建起着重要作用。过表达的Runx2能够促进成骨细胞早期分化, 并通过抑制成骨细胞成熟导致早期的、不成熟的成骨细胞数量增加[16]。本实验发现OM+LLLI组的Runx2表达量在第7天时即达到90%以上, 显著高于OM组(P< 0.01), 而到了第14天又显著降低至低于OM组(P< 0.01), 说明在成骨分化早期, LLLI可以促进hASCs转化成成骨细胞表型, 随着成骨细胞的发育成熟, Runx2的表达会逐渐减少, 但成骨分化晚期的标志物, 如OCN等表达量会增多。相比之下, 未接受激光照射的OM组中hASCs向成骨细胞的转化更为缓慢。Petri 等[17]从基因水平上也有类似的发现, 他观察了LLLI(波长780 nm, 能量密度3 J/cm2)对钛片上人成骨样细胞的作用, 发现照射后第14天照射组的OCN表达高于对照组, 而Runx2表达低于对照组。
综上, LLLI不会对hASCs/海藻酸钠/明胶三维生物打印体内hASCs存活率造成影响, 且可促进hASCs成骨向分化。后续实验将运用PCR、Western blot等定量方法来检测成骨相关基因及蛋白的表达, 进一步验证LLLI对三维生物打印体成骨分化的作用。
(本文编辑:赵 波)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|