目的: 利用X射线衍射增强成像(diffraction enhance imaging,DEI)的空间高分辨率和高相位衬度特征,对小鼠肝纤维化样本进行成像,观察纤维化病变在DEI图像中的表象特征,并对正常肝组织及肝纤维化图像进行纹理特征分析,探讨量化诊断肝纤维化病变的有效性。方法: 实验在北京同步辐射装置(Beijing Synchrotron Radiation Facility,BSRF)4W1A光束线形貌学实验站完成,样品为四氯化碳(carbon tetrachloride,CCl4)诱导的ICR小鼠肝纤维化模型及正常肝脏组织标本。对样品进行DEI成像后,对肝脏组织进行马松(Masson)染色,将DEI图像与病理结果进行比对,分析得到不同程度纤维化病变的影像学特征。基于灰度共生矩阵(gray level co-occurrence matrix,GLCM),计算DEI图像感兴趣区域(region of interest,ROI)的九种纹理特征参数,分析纹理特征参数与纤维化病变程度的相关性。结果: 正常及不同程度的肝纤维化组织在DEI图像上差异明显,能量、熵、惯性矩、逆差距、差的熵以及差的均值六种纹理特征值能够明显区分不同程度肝纤维化( P<0.05),其中,熵、惯性矩、差的熵、差的均值随着肝纤维化程度的加重而增大,而能量、逆差距随着肝纤维化程度的加重而减小,熵的变化程度最为明显。结论: 正常及不同程度的肝纤维化模型在DEI图像上差异明显,基于GLCM提取的图像纹理特征参数能够对不同程度的肝纤维化进行区分。DEI成像为肝纤维化的诊断提供了一种潜在的影像学途径。
Objective: X-ray diffraction-enhanced imaging (DEI) method was used to image hepatic fibrous samples, and the texture measurements based on DEI images were calculated and analyzed for investigating the feasibility of diagnosing fibrosis quantitatively.Methods: Hepatic fibrosis of different severity in ICR mice was induced by injecting with carbon tetrachloride (CCl4) olive oil solution for 21 d, 42 d and 84 d, respectively. The excised liver tissues were then imaged at the 4W1A Topography & Imaging Station of Beijing Synchrotron Radiation Facility (BSRF). After imaging, the liver tissues were sectioned and stained for Masson trichrome using standard histological techniques. The imaging features of hepatic fibrosis of different severity were analyzed by comparing DEI images with histological examinations. The nine basic texture parameters on regions of interest (ROIs) of DEI images were extracted based on the gray level co-occurrence matrix (GLCM), and then evaluated for their feasibility to distinguish stages of fibrosis.Results: The results showed that great differences could be observed in the DEI images between the normal and diseased mice in different stages of liver fibrosis. It was demonstrated that there were six texture measurements (entropy, inertia, difference entropy, difference average increase, energy and inverse difference moment) that could distinguish between the normal and diseased mice in different stages of liver fibrosis ( P<0.05). The texture parameters of entropy, inertia, difference entropy, difference average increased with the development of fibrosis, while the texture parameters of energy and inverse difference moment decreased with the development of fibrosis. The variation in entropy of different severity of fibrosis was most obvious among the six texture features.Conclusion: The degree of hepatic fibrosis can be discriminated by morphological features in DEI images. Moreover, the degree of hepatic fibrosis can be graded quantitatively by the texture features. These results suggest that DEI can be a promising noninvasive technique to diagnose and distinguish hepatic fibrosis of different degrees.
肝纤维化是肝脏对慢性损伤的一种愈合反应, 表现为肝细胞外间质成分过度异常沉积, 是慢性肝病发展到肝硬化的必经阶段[1, 2]。肝纤维化的病变是一个动态过程, 最终会发展为肝硬化、肝坏死甚至肝癌[3]。许多慢性肝病, 如慢性乙型肝炎、脂肪性肝炎等均可引起肝纤维化。大量动物及临床研究表明, 肝纤维化是可以逆转的, 然而肝硬化是不可逆的[4], 因此尽早确诊肝纤维化的病变程度, 对肝病治疗有着重要意义。目前, 肝活检病理学检查仍是诊断肝纤维化的“ 金标准” , 但由于肝脏病变的不均匀性, 可导致取样误差。另外, 肝活检是一种创伤性检查, 存在穿刺后疼痛以及其他并发症, 患者难以接受反复取材[5]。目前的影像学诊断方法, 如超声弹性成像, 主要测量的是肝组织弹性硬度的数值, 不能得到肝组织的影像学特征, 而B超、X射线计算机断层扫描成像(X-ray computed tomography, X-CT)及磁共振成像(magnetic resonance image, MRI)等由于受衬度和空间分辨率所限或成本较高, 不适用于肝纤维化的诊断[6, 7]。实现肝纤维化的无创诊断成为当前临床面临的挑战。
X射线相位衬度成像(phase contrast imaging, PCI)是基于X射线穿过被成像物体时产生的相位变化形成图像的衬度, 在医用射线强度领域, 弱吸收生物软组织的相位项比吸收项大1 000倍左右[8], 因此, 对传统X线无法显示的弱吸收的软组织, 如皮肤、韧带、神经及血管等也具有极高的分辨率[9, 10, 11]。而且PCI主要依赖于X射线穿过被成像物体时产生的相位变化, 而非吸收指数, 因此, 可以选择高能段X射线进行成像, 从而减少组织对射线的吸收剂量, 降低射线对组织的辐射损伤[12]。总之, PCI技术具有高穿透性、高对比度、高空间分辨率、低辐射的特点。
X射线衍射增强成像技术(diffraction enhanced imaging, DEI)是相位衬度成像法的一种[13]。DEI成像系统主要包括同步辐射光源、单色晶体、样品台、分析晶体和探测器。成像时, 同步辐射光经单色晶体产生单色光束, 单色光束透过样品入射到Bragg模式的分析晶体上, 经分析晶体的衍射、反射和小角散射, 最后在探测器上形成DEI图像。分析晶体可以相对于单色晶体在子午面内进行旋转, 固定单色晶体, 转动分析晶体, 则晶面对入射光束的反射率将随转角不同而变化, 该反射率随转角变化的函数曲线称为双晶摇摆曲线。在摇摆曲线的不同位置处, 可以得到不同衬度的DEI图像。当选取摇摆曲线的腰位, 分析晶体和单色器晶体之间的夹角为半个达尔文宽度, 沿入射方向射出的X射线可在分析晶体上获得约50%的反射率。与摇摆曲线腰位相对应, 其左、右腰位置为摇摆曲线两侧斜坡上最陡的点, 摇摆曲线陡峭的斜坡扮演了衬度放大器的角色, 斜坡越陡峭, 由折射引起的光强的改变越大, 相应的折射衬度越大。样品的腰位DEI图像能够反映样品的折射信息, 能够突显折射率变化较大的组织边界。DEI成像法能够极大地提高弱吸收体X射线的衬度和实际获得的空间分辨率, 是20世纪90年代后期发展起来的一种X射线成像模式, 在生物医学领域具有潜在的重要应用价值, 未来有着极大的临床应用前景。
本研究将DEI成像方法应用于纤维化病变的离体小鼠肝脏成像, 观察纤维化病变在DEI图像的表象特征, 并基于灰度共生矩阵(gray level co-occurrence matrix, GLCM)提取DEI图像感兴趣区域(region of interest, ROI)的纹理特征参数, 分析纹理参数与纤维化病变程度的相关性, 希望能为肝纤维化的无创诊断提供参考。
实验所用动物为无特定病原体(specific pathogen free, SPF)级的ICR雄性小鼠, 体重在18~22 g之间, 共15只, 购于北京大学医学部实验动物中心[许可证号:SCXK(京)2011-0012], 喂养于北京大学医学部实验动物中心清洁级动物室。随机分为对照组(3只)和模型组(12只)。
取12只作为模型组进行不同程度肝纤维化模型构建。模型组使用5%(体积分数)的四氯化碳(carbon tetrachloride, CCl4)橄榄油溶液按0.01 mL/g的剂量进行皮下注射, 并分别在第21、42、84天解剖小鼠, 取出肝脏组织, 将其置于10%中性福尔马林溶液中保存。对照组小鼠使用橄榄油按0.01 mL/g的剂量进行皮下注射, 并于第84天解剖小鼠并取出肝脏, 将其置于4%(体积分数)甲醛溶液中保存。在实验前一天, 将浸泡在甲醛溶液中的小鼠肝脏样本取出, 在自然条件下风干。成像时将样品切成厚度约为3 mm的小块, 成像后将样品放回甲醛溶液, 以备后续制作病理切片。所有动物处理过程都遵循动物福利和伦理准则, 并由北京大学医学部实验动物伦理委员会审核批准。
实验是在北京同步辐射装置(Beijing Synchrotron Radiation Facility, BSRF)的4W1A光束线形貌学实验站中完成的。4W1A是从4W1单周期扭摆磁铁引出的硬X射线白光束线, X射线能量范围为6~22 keV。形貌学实验站建在4W1A光束线出口处, 距发光点43 m。
图1为DEI成像装置的原理图和光学系统的照片。从4W1引出的X射线经第一单晶Si(111)单色器, 成为单色光。第二晶体Si(111)为分析晶体, 距第一单晶约30 cm, 样品置于两晶体间, 成像的有效光斑面积为20 mm(水平)× 10 mm(垂直)。实验时, 用橡皮泥将肝脏组织固定在样品架上。根据需要选择摇摆曲线上左腰的位置进行扫描, 能量选择15 keV, 曝光时间为120 ms, 探测器使用分辨率为7.4 μ m的电荷耦合元件(charge-coupled device, CCD)。
观察各肝脏DEI图像, 分析正常及不同程度肝纤维化的DEI图像表象, 并基于灰度共生矩阵提取图像的纹理特征参数[14, 15]。从DEI图像上截取感兴趣区域, 截取的图像像素大小为30像素× 30像素的小块图像, 每幅图像随机截取8个感兴趣区域, 由于每幅图像包含的血管部分都不一样, 而血管对图像的纹理参数影响很大, 所以感兴趣区域的选取尽量避免含大血管的部分。本实验将原图产生的灰度共生矩阵线性映射到K=64, 在四个方向上取均值并归一化后, 分别计算出各组图像的能量(energy)、熵(entropy)、惯性矩(inertia)、相关(correlation)、和的均值(sum average)、和的熵(sum entropy)、逆差距(inverse difference moment)、差的熵(difference entropy)以及差的均值(difference ave-rage)共九种纹理参数。
上述纹理参数是描述图像纹理特征的基本参数。其中能量反映了图像灰度分布均匀程度和纹理粗细程度, 该测度对区域内部有无灰度变化较敏感, 但对灰度变化数值大小不敏感, 即具有高的局部灰度对比度的区域能量值不一定高; 非均匀区的能量比均匀区的能量要小。熵反映的是图像纹理的随机性, 描述的是图像所具有的信息量, 该测度可以用于区分有结构纹理的组织与缺少纹理的组织, 前者的熵值要小些。惯性矩反映了图像的清晰度和纹理沟纹深浅的程度, 强调大灰度变化的作用, 该测度对非均匀区的局部对比度敏感; 非均匀区的惯性矩值大, 均匀区的惯性矩值小。逆差距反映局部同质性, 即用来度量图像纹理局部变化是否均匀。基于上述四种纹理特征参数可以定义相关、和的均值、差的均值、和的熵、差的熵这五种基本纹理特征参数。
成像后对样品进行常规脱水, 石蜡包埋, 制成厚度为4 μ m的切片, 进行马松(Masson)染色, 用光学显微镜成像, 并由北京大学第三医院一位病理学专家进行分级。肝纤维化依据半定量METAVIR评分标准, 共分为五期[16, 17]。对照组、模型组第21天、模型组第42天、模型组第84天的肝纤维化分级分别为正常S0期、轻度肝纤维化S1期、中度肝纤维化S2期、重度肝纤维化S3期。
本文利用SPSS 20.0软件进行数据统计分析。纹理参数的结果以平均值± 标准差表示; 多组均值的比较采用单因素方差分析, 组间比较依据LSD方法。P< 0.05表示差异有统计学意义。
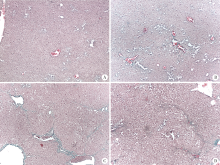
从图2中可以清晰地将微米级的血管与周围组织区分。图2A肝脏血管清晰, 血管壁均匀光滑, 血管与肝组织边界清楚, 肝组织纹理结构均匀, 图像还显示出部分血管影像的重叠现象。图2B血管不再光滑规则, 出现轻微的变形, 肝脏纹理也不再均匀。相比于图2B, 图2C血管壁更加不光滑, 血管形变更为严重, 部分血管分布紊乱, 分支受阻, 细小血管变得不可见, 肝脏纹理也更为粗糙。图2D中的血管壁最不光滑, 血管形变最为严重, 细小血管不可见, 肝组织纹理结构异常粗糙。
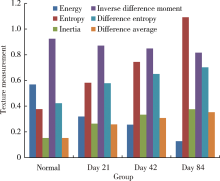
DEI图像显示出正常及不同程度纤维化肝组织纹理结构表象不同, 对ROI的纹理特征参数分析也显示出这种差异。研究结果显示, 能量、熵、惯性矩、逆差距、差的熵以及差的均值六种纹理特征值能够明显区分不同程度肝纤维化(P< 0.05), 均能区分正常和不同程度肝纤维化的肝脏组织, 如表1和图3所示。
| 表1 纹理参数的结果( |
第21、42、84天的纤维化样品与正常样品的纹理参数偏差如表2所示, 惯性矩、熵、差的熵、差的均值随着肝纤维化严重程度的加重而增大, 能量、逆差距随着肝纤维化严重程度的加重而减小, 其中熵对区分正常和不同程度纤维化组织的差异最敏感。
| 表2 肝纤维化样品与正常样品的纹理参数偏差 Table 2 The deviation of the texture parameters between the fibrosis samples and the normal samples |
图4A显示了正常肝脏的图片。图4B可见肝细胞水肿, 小泡型肝细胞脂肪变性, 汇管区纤维化扩大, 局限窦周及小叶内纤维化, 属于S1期, 为轻度肝纤维化。图4C可见肝细胞水肿, 肝细胞脂肪变性, 汇管区周围纤维化纤维间隔形成, 小叶结构保留, 属于S2期, 为中度肝纤维化。图4D可见肝细胞水肿, 肝细胞脂肪变性, 肝细胞坏死, 多个坏死灶, 并可见汇管区炎细胞浸润, 纤维间隔形成伴小叶结构紊乱, 无肝硬化, 属于S3期, 为重度肝纤维化。病理图像与DEI结果一致。
本文利用DEI对小鼠肝脏成像, 不仅清晰地显示出不同纤维化程度的肝脏表象特征, 而且利用纹理特征分析对不同程度的肝纤维化进行了定量区分。
肝组织的病理分级结果显示, 正常肝组织结构完整规则; 随着肝纤维化程度的加重, 纤维隔状结构形成并越来越显著, 肝组织结构被破坏并变得更加紊乱。DEI图像结果显示, 正常肝脏纹理结构规则均匀, 血管壁均匀光滑, 血管与肝组织边界清楚; 随着纤维化程度的加重, 肝脏纹理结构更显粗糙, 血管变形更为严重, 血管分布更加紊乱, 分支更模糊, 细分支血管的结构被破坏, 变得不可见。DEI图像的表象特征与病理分级结果一致。图像的纹理特征参数计算结果表明, 随肝纤维化严重程度的加重, 惯性矩、熵、差的熵、差的均值增大, 能量、逆差距减小。纹理特征参数变化趋势与病理结果一致。
DEI图像中显示的血管变化和肝组织纹理结构的改变是由纤维组织压迫所致:不规则的纤维化形态使血流受阻, 血管失去部分自身代偿功能作用, 形成其他不规则分支, 随着纤维化程度加重, 肝实质被破坏, 形成纤维间隔, 血管紊乱, 分支模糊, 血管壁不均匀变形, 细小的血管由于受到纤维组织的压迫而扭曲变形, 加上纤维间隔状结构的存在, 因而在DEI图像上会被掩盖; 肝组织纹理结构的改变来源于肝纤维间隔的出现。
图像显示出部分血管影像的重叠现象则是因为成像样品较厚, 硬X射线穿透样品时, 多层组织同时成像, 最终的图像由多层组织的图像叠加在一起, 产生影像重叠。
纹理是一种视觉感知的图像局部特征综合。由于纹理是由灰度分布在空间位置上反复出现而形成的, 因而在图像空间中相隔一定距离的两象素之间会存在一定的灰度关系, 即图像中灰度的空间相关特性。灰度共生矩阵就是一种通过研究灰度的空间相关特性来描述纹理的常用方法, 其不仅包含灰度统计信息, 而且反映灰度分布的空间信息。从灰度共生矩阵出发, 可以提取肝脏DEI图像纹理的一系列特征, 从而对肝脏纤维化的严重程度进行定量分析。实验结果表明, 惯性矩、熵、差的熵、差的均值、能量以及逆差距能有效地用于评价肝纤维化的严重程度, 其中熵最为适合。
本实验探讨了用DEI来诊断肝纤维化并区分不同程度纤维化的可行性, 研究表明DEI可以用来观察肝纤维化, 并能对其不同的严重程度进行区分。DEI这项新技术对肝纤维化的诊断具有高敏感性、无侵害性、无需造影剂、不会因取样的不均匀而产生抽样误差等优点。本文展示了研究的初步结果, 接下来我们将增加样本量, 对早期肝纤维化到肝硬化进行系统的研究, 并在DEI图像与病理组织图像之间进行广泛、系统的比较。另外, 三维重建以及活体成像也将成为下一步的研究重点。
总之, DEI能很好地区分正常及不同程度的肝纤维化模型:图像的表像特征能够区分正常和不同程度的肝纤维化, 基于灰度共生矩阵提取的纹理特征能够对不同程度的肝纤维化进行定量区分并分级。DEI成像为肝纤维化的诊断提供了一种潜在的影像学途径。
(本文编辑:赵 波)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|