SUMMARY Pharmacokinetic parameters can be significantly altered for acute kidney injury (AKI), extracorporeal membrane oxygenation (ECMO) and continuous veno-venous hemofiltration therapy (CVVH). Here we reported a case of individualized vancomycin dosing for a patient diagnosed as severe acute pancreatitis treated with concurrent ECMO and CVVH. A 65 kg 32-year-old woman was admitted to hospital presented with severe acute pancreatitis (SAP), respiratory failure, metabotropic acidosis and hyperkalemia. She was admitted to intensive care unit (ICU) on hospital day 1 and was initiated on CVVH. She progressed to multiple organ dysfunction syndrome (MODS) and acute respiratory distress syndrome (ARDS) on ICU day 2, and veno-venous ECMO was instituted. Several catheters were inserted into the body to support ECMO, CVVH and pulse indicator continuous cardiac output (PiCCO), so vancomycin was prescribed empirically on ICU day 3 for prevention of catheter-related infection. Given the residual renal function and continuous hemofiltration intensity on day 3, vancomycin bolus of 1 000 mg was prescribed, followed by a maintenance dose of 500 mg every 8 hours. On ICU day 4, a vancomycin trough serum concentration of 14.1 mg/L was obtained before the fourth dose, which was within the target range of 10-20 mg/L. By ICU day 7, vancomycin dosage was elevated to 1.0 g every 12 hours because of aggravated infection and improved kidney function. On ICU day 14, a vancomycin trough serum concentration of 17 mcg/mL was obtained. Her white blood cell (WBC) and neutrophil percentage (Neut%) dropped to the normal level by ICU day 19. This vancomycin regimen was successful in providing a target attainment of trough serum concentration ranging from 10-20 mcg/mL quickly and in controlling infection-related symptoms and signs properly. With the help of this case report we want to call attention to the clinically significant alteration in vancomycin pharmacokinetics among critically ill patients. Individualized vancomycin dosing regimens and therapeutic drug monitoring are necessary for critically ill patients receiving CVVH and ECMO to ensure that the target serum vancomycin levels are reached to adequately treat the infection and avoid nephrotoxicity.
万古霉素是临床常用的糖肽类抗菌药物, 用于革兰阳性球菌感染, 特别是耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)感染的一线治疗, 具有治疗窗窄、肾毒性的特点[1]。2016年《中国万古霉素治疗药物监测指南》[2]推荐对重症患者进行万古霉素治疗药物监测, 对于重症成人患者推荐10~20 mg/L为目标谷浓度, 并基于药代动力学原理和方法进行个体化给药。
重症患者病情危重、复杂, 常使用各种生命支持手段, 如呼吸机、肾脏替代治疗(renal replacement therapy, RRT)、体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)等, 不同的生命支持手段对患者体内万古霉素药代动力学特征的影响可能不同。有研究表明, 50%以上接受ECMO治疗的患者同时接受RRT[3], 目前尚未见RRT与ECMO联合使用时, 针对患者万古霉素药代动力学特征变化的报道或相关研究。RRT有多种类型与模式, 危重患者中常用连续性静脉-静脉血液滤过(continuous veno-venous hemofiltration, CVVH)模式。
本文报道了1例以CVVH联合ECMO作为生命支持治疗的急性重症胰腺炎患者, 探讨该患者万古霉素的体内药代动力学特征, 以期为该类患者有效、安全使用万古霉素提供参考。
患者女, 30岁, 因“ 上腹持续剧烈胀痛1天伴呕吐1次” 于2016年4月26日入院。
体格检查与辅助检查:神志清晰, 精神可, 体温40.0 ℃, 脉搏152次/min, 呼吸20次/min, 血压85/50 mmHg(1 mmHg=0.133 kPa), 上腹有压痛。
血生化检查:脂肪酶大于2 000 U/L, 淀粉酶851 U/L, 血清肌酐(serum creatinine, Scr)230 μ mol/L, 血清钾 6.3 mmol/L。
血气分析:pH 7.26, 动脉氧分压(PaO2)102 mmHg, 二氧化碳分压(PaCO2)23 mmHg。腹部增强CT提示重度脂肪肝、胰腺周围渗出、胆管下段钙化水肿。
患者为急性病程, 暴饮暴食后出现持续剧烈腹痛伴恶心、呕吐, 为典型急性胰腺炎的临床表现, 血生化检查提示脂肪酶、淀粉酶升高3倍以上, 腹部CT提示胰腺周围渗出, 符合胰腺炎诊断标准, 根据Ranson评分及CT积分, 诊断为急性重症胰腺炎, 合并呼吸衰竭、肾衰竭、休克, 病情危重。入院第1天转入危重症监护病房(intensive care unit, ICU)抢救治疗, 入ICU诊断:(1)急性重症胰腺炎, (2)Ⅰ 型呼吸衰竭, (3)代谢性酸中毒, (4)高钾血症, (5)急性肾衰竭, (6)腹腔间隔室综合征。
入ICU后给予患者气管插管、呼吸机辅助呼吸、ECMO、CVVH支持治疗, 给予维持血压、体液复苏、镇静、骨骼肌松弛、抑制胃酸分泌、抑制胰酶分泌、抗感染等药物治疗。
本文将重点探讨万古霉素的个体化给药与治疗药物监测(therapeutic drug monitoring, TDM)过程。
患者入ICU病房第1天, 呼吸困难, 血气分析示pH 7.05、PaO2 65 mmHg、PaCO222 mmHg, 紧急给予气管插管、呼吸机机械通气, 模式:SIMP+PS, 参数:吸入氧浓度(fraction of inspired oxygen, FiO2)60%。患者病情进展迅速, 腹压最高超过25 mmHg, 符合腹腔间隔室综合征, 合并多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)、急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS), 炎症反应剧烈, 有效循环血容量严重不足, 伴休克。患者病情危重, 给予CVVH提供循环支持以清除炎症介质, 维持内环境稳定。
入ICU病房第2天, 呼吸机机械通气, 模式:SIMP+PS, 参数:FiO2100%, 呼气末正压(positive end expiratory pressure, PEEP) 15 cmH2O(1 cmH2O=0.098 kPa), 呼吸频率14次/min, 血气分析示PaO244 mmHg。患者存在严重低氧血症, 呼吸机支持难以维持, 给予静脉-静脉体外膜肺氧合(veno-venous extracorporeal membrane oxygenation, V-V ECMO)改善氧合。
入ICU病房第3天, 联合应用CVVH与ECMO治疗, 患者体温37.1 ℃, 辅助检查示:白细胞(white blood cell, WBC)11.14× 109/L, 中性粒细胞百分数(neutrophil percentage, Neut%)75.8%, Scr 144 μ mol/L。因患者右肱动脉, 左股动脉, 右颈内静脉, 左、右股静脉留置多重管路, 考虑球菌感染的风险较高[4], 采用万古霉素预防感染, 综合考虑患者的肾功能状态(急性肾衰竭)、CVVH及ECMO治疗, 请药师联合会诊指导万古霉素的给药方案。
根据患者的年龄、性别、体重(65 kg)、估测的肌酐清除率(creatinine clearance, Ccr)(55 mL/min, Cockcroft-Gault公式[5])以及万古霉素群体药代动力学参数[6], 采用SHIONOGI-VCM-TDM S1-1软件计算, 给予万古霉素0.5 g/次、每8 h一次的给药方案时, 万古霉素的稳态谷浓度预计约为17 mg/L。考虑到患者肾功能不全, 为迅速达到稳态浓度, 药师建议初始给药方案为负荷剂量1 g(当日11:00), 维持剂量为0.5 g、每8 h一次(当日16:00开始), 于第4剂给药前测定万古霉素的血药浓度。
患者入ICU第4天5:30抽血测得万古霉素的血药浓度为14.1 mg/L, Scr为109 μ mol/L。基于群体药代动力学结合贝叶斯反馈法(Bayesian me-thod)[7], 将血药浓度、当日估测的Ccr 68 mL/min(Cockcroft-Gault公式)带入SHIONOGI-VCM-TDM S1-1软件进行拟合, 显示预计达稳时的谷浓度为14.4 mg/L, 拟合得到的血药浓度-时间预测曲线如图1所示, 此时患者的实测血药浓度接近预计达稳时的谷浓度, 考虑患者血药浓度已达稳。药师建议维持当前0.5 g/次、每8 h一次的给药方案, 若感染控制不佳且肾功能改善, 必要时可考虑调整给药方案为1 g/次、每12 h一次。
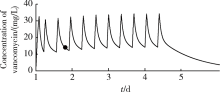 | 图1 入ICU 第4天采用SHIONOGI-VCM-TDM S1-1 软件拟合得到的万古霉素血药浓度-时间曲线Figure 1 Predicted vancomycin serum concentration-time curve on ICU day 4 |
入ICU第7天, 体温37.6 ℃。辅助检查示:WBC 33.39× 109/L, Neut% 84.8%, Scr 84 μ mol/L。考虑患者WBC持续上升, Scr持续下降, 建议增加万古霉素给药剂量至1 g/次、每12 h一次, 并于调整给药方案后第3剂给药前测定血药浓度。
入ICU第8天, 体温38.8 ℃。辅助检查示:WBC 46.31× 109/L, Neut% 86.1%, Scr 133 μ mol/L, 降钙素原(procalcitonin, PCT)3.16 μ g/L, 晨7:00测得万古霉素血药浓度为 20.5 mg/L。患者感染相关指标持续上升, 考虑患者目前感染较重, 尽管血药浓度略偏高且Scr上升, 但暂不予调整万古霉素剂量, 密切监测患者肾功能, 必要时根据血药浓度调整万古霉素给药方案。
入ICU第9天, 患者体温 38.4 ℃。辅助检查示:WBC 33.53× 109/L, Neut% 90.4%, Scr下降至112 μ mol/L。血气分析示:pH 7.4, PaO2 126 mmHg, PaCO2 32 mmHg。患者WBC持续升高, 目前体内置入多重管路, 考虑由导管引发感染的可能性大。当前PaO2较前明显升高, 故逐渐降低ECMO参数至撤除ECMO管路, 以利于感染控制。考虑ECMO对万古霉素药代动力学的影响较CVVH小[8, 9, 10, 11, 12], 因此未调整万古霉素的给药方案。
入ICU第14天, 晨5:30测得万古霉素的血药浓度为17.0 mg/L, 万古霉素的谷浓度较适宜, 维持1 g/次、每12 h一次的给药方案。
入ICU第20天, 继续CVVH支持治疗, 患者体温 38.2 ℃。辅助检查示:WBC 6.95× 109/L, Neut% 75.8%, 血小板45× 109/L, 凝血酶原时间19.1 s, 活化部分凝血活酶时间80.5 s。患者凝血功能紊乱, 输注血小板、纤维蛋白原疗效不佳, 考虑可能与病情严重程度相关, 不除外药物因素。目前感染较前明显好转, 暂停多种药物以除外药物因素的影响, 其中包括万古霉素。
入ICU第22天, 患者体温38.3 ℃。血常规示:WBC 10.64× 109/L, Neut% 85.1%, 血小板32× 109/L。根据药敏结果进行抗感染治疗, 经过积极的体液复苏、镇静、肌松、抑酸抑酶、抗感染等治疗, 患者生命体征逐渐稳定。患者的万古霉素给药方案、血药浓度测定结果及使用万古霉素期间感染情况、肾功能相关监测指标见表1~3。
| 表1 万古霉素的给药方案 Table 1 Summary of vancomycin dosing regimens |
| 表2 万古霉素的血药浓度测定结果 Table 2 Summary of vancomycin serum concentrations |
| 表3 患者使用万古霉素期间体征监测情况 Table 3 Summary of patient’ s signs related to infection and renal function |
本例患者病情危重, 患者在ECMO支持期间, 右肱动脉, 左股动脉, 右颈内静脉, 左、右股静脉留置多重管路, 于入ICU第3天开始经验性使用万古霉素预防感染。我们考虑本例患者使用万古霉素预防导管相关性血流感染比较合理, 原因如下:(1)在接受ECMO治疗的患者中, 由MRSA引起的医院获得性血流感染风险增加3倍[13], 2014年《体外膜肺氧合循环支持专家共识》也提出, 管路置入易导致血行感染, 应常规给予广谱抗生素预防感染。(2)患者体内留置多重管路, 是多种球菌感染的高危因素, 感染发生率高, ICU中早期使用抗菌药物预防感染可以显著降低导管相关感染的发生率[4]。(3)本例患者病情危重, 一旦发生血流感染会影响患者的生存, 有研究提示在ICU患者中早期预防性使用抗菌药物可降低死亡率(OR=0.80, 95% CI:0.69~0.93)[14]。
ECMO是暂时的生命支持系统[15], 本例患者使用的是V-V ECMO, 旨在纠正患者的呼吸衰竭及氧合指数过低。探讨成人患者ECMO治疗对万古霉素药代动力学影响的临床研究相对较少, 且样本量较小。表4给出了一些相关研究的基本信息及结论要点, 研究结果显示, ECMO治疗对万古霉素的药代动力学参数影响不显著[8, 9, 10, 11]。考虑到上述研究结果, 我们在万古霉素治疗过程中重点考察了CVVH的影响。
| 表4 ECMO支持下的万古霉素药代动力学特征 Table 4 Pharmaceutics of vancomycin in adults receiving ECMO |
在接受RRT的患者中, 万古霉素的清除速率为肾脏清除与体外清除之和[12]。当血滤的超滤率为45 mL/(kg· h)时, 体外清除率占总清除率的50%~60%[16]。本例患者行CVVH期间超滤率约为50 mL/(kg· h), 因此在制定万古霉素给药方案时需综合考虑万古霉素的肾脏清除与CVVH对万古霉素的清除。有些研究分析了接受CVVH治疗的患者中万古霉素药代动力学的变化[16, 17], 结果显示万古霉素通过CVVH的清除率与超滤率和筛过系数相关, 超滤率越大, 清除率越高; 万古霉素的筛过系数约为0.7~0.9, 因此通过CVVH的清除率较高。
综上, 与ECMO相比, CVVH对万古霉素的药代动力学特征影响更大, 故在调节万古霉素剂量时应首先考虑CVVH的影响, 但在实际应用过程中, 由于患者肾功能基线的差异及CVVH参数设置的不同, 固定的推荐剂量很难普及使用, 尚未见定量阐述患者肾功能、CVVH强度与万古霉素给药剂量之间关系的研究, 因此通过治疗药物监测及时调整给药方案很有必要。
本例患者入ICU期间给予CVVH(第1~28天)联合ECMO(第2~7天)支持治疗, 在应用万古霉素(第3~19天)的过程中, 治疗初期综合考虑患者肾功能、CVVH与ECMO治疗对万古霉素药代动力学的影响后给予初始给药方案; 为使血药浓度尽快达稳, 给予了负荷剂量; 在用药过程中持续监测患者的感染相关指标、Scr, 并在调整给药方案后、Scr发生较大波动时及时监测万古霉素的血药浓度; 利用群体药代动力学及贝叶斯反馈模型预测患者的血药浓度, 以实现万古霉素的个体化给药。在抗感染治疗过程中, 未出现导管相关血流感染, 且WBC水平、PCT水平有明显的下降, 最终较好地控制了感染相关症状与体征, 也较好地控制了万古霉素的血药浓度及其肾毒性。
本例患者万古霉素的使用有以下3方面的提示:(1)重症感染患者在万古霉素治疗初始有必要给予负荷剂量。现有的关于万古霉素治疗药物监测指南[2, 18, 19]均推荐对重症患者和复杂感染患者给予负荷剂量以使血药浓度尽快达到目标浓度。考虑到本例患者急性肾衰竭, 尽管行CVVH治疗, 但较常规剂量仍需减量, 因此给予负荷剂量(1 g)+维持剂量(0.5 g/次、每8 h一次), 该给药方案经血药浓度监测和贝叶斯反馈拟合证实, 可迅速达稳。(2)与ECMO相比, CVVH对万古霉素药代动力学特征的影响更大。尽管有研究表明, ECMO可能会增加万古霉素的清除率, 但影响并不显著[8, 9, 10, 11], 而CVVH的强度与万古霉素的清除率密切相关, 在给药方案设计与剂量调整的过程中, 应重点考虑CVVH的影响。(3)TDM结合群体药代动力学(population pharmacokinetics, PPK)模型可以为万古霉素的剂量调整提供参考。PPK结合贝叶斯反馈预测模型可直观、准确地预测万古霉素的血药浓度, 从而优化患者的个体化用药[7]。本例患者在万古霉素的用药过程中, PPK及贝叶斯反馈模型预测得到的血药浓度-时间曲线和稳态血药浓度为其剂量调整提供了良好的参考。
危重患者病情复杂, 常伴器官功能不全, 可能同时接受CVVH、ECMO等多种生命支持治疗。万古霉素在危重患者中的药代动力学比较复杂, 受多种因素影响, 难以找到固定给药方案, 急需个体化给药。应综合考虑可能影响万古霉素药代动力学的相关因素, 在危重患者中开展万古霉素治疗药物监测与个体化给药服务, 改善患者结局。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|


