目的 探讨Toll样受体 (Toll like receptors, TLR)对人牙周膜干细胞成骨分化的影响及其可能的分子机制。方法 应用实时荧光定量聚合酶链式反应(real-time polymerase chain reaction, real-time PCR)及流式细胞术检测TLR在人牙周膜干细胞 (human periodontal ligament stem cells, hPDLSCs)上的表达。在成骨培养基中加入多种浓度的不同TLR配体培养7~14 d,检测TLR对hPDLSCs成骨的影响。通过Western blotting方法检测TLR配体刺激hPDLSCs 7 d后,丝裂原活化蛋白激酶 (mitogen activated protein kinase, MAPK)及蛋白激酶B (protein kinase B, PKB or AKT) 磷酸化水平的变化及runt相关转录因子2 (runt related transcription factor 2, Runx2)的变化,并对比加入MAPK及AKT抑制剂后Runx2的变化, 探究TLR是否通过影响下游的MAPK及AKT的活化而影响hPDLSCs的成骨分化。结果 TLR1、TLR3、TLR4、TLR6在hPDLSCs上表达较高, 不同TLR的阳性细胞百分比为TLR1 2.82%±0.68%,TLR2 1.26%±0.09%,TLR3 13.23%±2.05%,TLR4 3.64%±0.79%,TLR6 3.21%±1.64%,其趋势与TLR 在hPDLSCs中mRNA表达相一致。高浓度的TLR配体 (PolyI:C 10 mg/L, LPS 10 mg/L , Pam3CSK4 1 mg/L, FSL-1 50 μg/L) 刺激hPDLSCs可减少矿化结节的形成, 减弱ALP染色及降低ALP活性。高浓度TLR配体刺激还可下调细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)、P38、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)及AKT的磷酸化水平, 伴随Runx2的表达水平下调, 应用MAPK及AKT抑制剂也可下调Runx2的表达。结论 高浓度的TLR配体刺激可抑制hPDLSCs的成骨分化, 这种抑制作用和MAPK及AKT磷酸化降低相关。
Objective: To investigate the effects of Toll like receptors on the osteogenesis of human pe-riodontal ligament stem cells (hPDLSCs) and probable molecular mechanism.Methods: Real-time PCR and flow cytometry were applied to test the expression of TLRs in hPDLSCs and the positive cell percentage of TLR. hPDLSCs were cultured in osteogenic medium for 7 to 14 days with different TLR agonists at various concentrations . The effect of different TLR on osteogenic differentiation of hPDLSCs was evaluated by alizarin red S staining, alkaline phosphatase (ALP) staining and ALP activity assay. Western blotting was used to analyze the phosphorylation levels of extracellular regulated protein kinases (ERK), c-Jun N-terminal protein kinase (JNK), P38, AKT and expression of Runx2 an osteogenic related gene after treatment with TLR agonists, compared with the effect of inhibitors of mitogen activated protein kinase (MAPK) or protein kinase B (PKB or AKT) on Runx2 expression of hPDLSCs cultured in osteogenic medium.Results: Higher expressions of TLR1,3,4,6 were found in hPDLSCs through real-time PCR. Positive cell percentage of TLR was determined by flow cytometry and described as TLR1: 2.82%±0.68%; TLR2: 1.26%±0.09%; TLR3: 13.23%±2.05%; TLR4: 3.64%±0.79%; TLR6: 3.21%±1.64%, whose tendency was comparable to their mRNA expression in hPDLSCs. Most TLR ligands had no effect on the ALP staining, activity and mineralization of hPDLSCs at lower concentration except for 0.1 mg/L PolyI:C could induce the osteogenic ability of hPDLSCs. On the contrary, Higher concentration of TLR ligands (PolyI:C: 10 mg/L, LPS: 10 mg/L , Pam3CSK4: 1 mg/L, FSL-1: 50 μg/L) had obviously inhibitory effect on osteogenic differentiation of hPDLSCs. Activation of TLR using higher concentration of TLR ligands could downregulate the phosphorylation levels of ERK, P38, JNK and AKT, and also reduced the expression of Runx2, compared with the untreated control. The inhibitors of MAPK (U0126, SP600125,SB203580) and inhibitor of AKT (perifosine) could also inhibit Runx2 expression.Conclusion: Higher concentration of TLR ligands could inhibit osteogenic differentiation of hPDLSCs. This inhibitory effect seemed to be related to decreased phosphorylation of MAPK and AKT.
牙周炎是一种常见的慢性口腔疾病, 会导致牙周组织的破坏甚至牙齿脱落, 既往研究表明, 牙周膜干细胞在体内外具有良好的多能分化能力, 并且较易获得, 在牙齿及牙周修复中有很好的临床应用前景[1, 2, 3]。Toll样受体( Toll like receptors, TLR ) 属于Ⅰ 型跨膜糖蛋白, 通过识别一些特定的病原体分子模式(pathogen associated molecular patterns, PAMPs), 参与固有免疫和获得性免疫反应[4]。除了参与炎症反应, TLR还参与组织的修复, 在此过程中, TLR下游信号分子, 如丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)和磷脂酰肌醇3(phosphatidylinositol 3-kinase, PI3K)均发挥关键作用[5, 6, 7]。有学者报道[4], TLR不仅表达于免疫细胞, 在间充质干细胞中也有表达, 而且对于干细胞的多种功能具有调节作用, 但大部分研究结果源于骨髓间充质干细胞和脂肪干细胞。目前, TLR对人牙周膜干细胞功能影响方面的研究尚不多见, 特别是针对TLR是否影响人牙周膜干细胞的成骨分化及机制方面的研究也不充分。本研究旨在验证TLR在人牙周膜干细胞中的表达, 并探讨TLR对人牙周膜干细胞成骨的影响及其可能的分子机制, 为今后牙周膜干细胞更好地应用于临床牙周修复提供一定的理论依据。
Trizol试剂盒、逆转录试剂盒、RIPA裂解缓冲液、蛋白酶抑制剂试剂盒均购于美国Invitrogen公司, SYBGREEN购自美国Roche公司, TLR4 配体脂多糖(lipopolysaccharide, LPS) 购自美国Sigma Aldrich公司, TLR3 的配体 PolyI:C、TLR1/2 的配体 Pam3CSK4 及TLR6 的配体 FSL-1 购自美国 InvivoGen公司, Western blotting实验的一抗(phosphate AKT、AKT、phosphate P38、P38、phosphate ERK、ERK、phosphate JNK、JNK)购自美国Cell Signal Technology公司, 流式抗体anti-humanTLR1-PE(clone GD2.F4)、anti-human TLR3-PE (clone TLR 3.7)、anti-humanTLR4-PE (clone HTA125)、anti-human TLR2-PE (clone TL2.1)、anti-human TLR6-PE (clone TLR6.127) 购自美国eBioscience和Biolegend公司, 同型对照抗体isotype control mouse IgG2a κ PE 和 isotype control mouse IgG1 κ 购自美国eBioscience公司, U0126 (ERK抑制剂)、SP600125 (JNK抑制剂)、SB203580 (P38抑制剂)、Perifosine (AKT抑制剂)均购自美国Sigma Aldrich公司。引物由上海生工生物技术公司合成, 引物序列见表1。
| 表1 TLR及GAPDH的特异引物序列 Table 1 The specific primers of TLR and GAPDH |
取临床13~25周岁因正畸或阻生拔除的健康、完整且无龋恒牙[均经患者书面知情同意, 本研究开始前已经北京大学口腔医院伦理委员会审查批准(PKUSSIRB-201630098)], 放入含抗生素的培养基, 无菌条件下尖镊撕下牙周膜, 充分剪碎至泥浆状。加入Ⅰ 型胶原酶(2 g/L)与分散酶dispase (4 g/L) 1 ∶ 1(体积比)混合的溶液, 置于37 ℃消化60 min。加入等体积培养基终止消化, 1 200 r/min离心6 min, 弃上清, 重悬细胞后接种至10 cm培养皿, 加入10 mL 含15% (体积分数)胎牛血清(Hyclone公司, 美国)和1%(体积分数)双抗(SIGMA公司, 美国)的 α -MEM培养基(GIBCO公司, 美国), 7 d后每3天换液1次, 长至80%~90%融合时消化细胞, 传代培养。
应用Trizol(Invitrogen公司, 美国)法提取人牙周膜干细胞的RNA, 逆转录为cDNA后通过real-time PCR检测TLR在人牙周膜干细胞上转录水平的表达。人TLR1~TLR10引物序列见表1, 实验重复3次以上。
培养的牙周膜干细胞用0.25%(质量分数)胰蛋白酶消化, 完全培养基终止消化, 1 200 r/min离心后, 用含0.5%(体积分数) 胎牛血清的PBS缓冲液洗2次, 离心后重悬为单细胞悬液, 加入流式抗体, 冰上孵育30 min。对于TLR3抗体, 还需要破膜过程后再行染色, 染色后用PBS缓冲液洗2次, 应用BD Accuri C6流式细胞仪进行检测, 实验重复3次。
1.5.1 ALP染色实验 将hPDLSCs以8× 104密度接种于24孔板, 加入不同刺激剂, 成骨诱导培养7 d, 中间换液1次, 用4%(体积分数)多聚甲醛室温固定15 min。采用康为世纪ALP染色试剂盒, 按照产品说明书进行ALP染色实验, 实验重复3次。
1.5.2 ALP活性定量分析 将hPDLSCs以1.5× 105密度接种于6孔板, 加入不同刺激剂, 成骨诱导培养7 d, 中间换液1次。用RIPA蛋白提取缓冲液提取细胞总蛋白, BCA试剂盒定量蛋白浓度, 按LabAssayTMALP试剂盒(Wako公司, 日本)说明书检测ALP活性并进行定量分析, 实验重复3次。
1.5.3 茜素红矿化结节染色及半定量分析 将hPDLSCs以8× 104密度接种于24孔板, 加入不同刺激剂, 成骨诱导培养14 d, 中间换液2次, 用4%(体积分数)多聚甲醛室温固定15 min, 加入茜素红染液(pH=4.2)室温染色20 min, 蒸馏水洗3遍, 进行大体及显微镜下拍照。每孔加入茜素红裂解液(体积比乙酸︰甘油=5︰1)1 mL, 室温放置30 min, 于405 nm检测光密度, 实验重复3次。
按说明书应用RIPA提取细胞总蛋白, 用BCA试剂盒定量蛋白浓度。蛋白上样量为30~40 μ g, 用10%(质量分数)SDS-聚丙烯酰胺凝胶进行电泳, 蛋白转至PVDF膜。5%(质量分数)脱脂牛奶室温封闭1 h后, 加入一抗4 ℃孵育过夜。TBST室温洗3遍, 加入标记辣根过氧化物酶种属特异性的二抗, 室温孵育1 h, TBST室温洗3遍, 应用ECL显色试剂盒在BIORAD成像系统曝光成像, 后应用IMAGE J软件分析条带, 实验重复3次。
应用Graphpad prism软件进行统计分析, 定量资料采用均数± 标准差表示, 组与组比较采用t检验, 多组比较采用单因素方差分析法(One way ANOVA), 多组之间任意两组比较用Turkey法, P< 0.05认为差异有统计学意义。
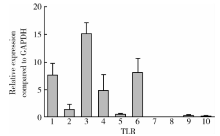
2.1.1 TLR1、TLR 3、TLR 4、TLR 6 mRNA在hPDLSCs上有较高的表达, 而TLR7、TLR 8、TLR 10的mRNA表达水平很低 应用real-time PCR检测TLR1~TLR10在hPDLSCs转录水平的表达, 结果以2-Δ CT表示, 发现TLR1、TLR 3、TLR 4、TLR 6表达水平相对较高, 而TLR7、TLR 8、TLR 10的表达水平很低(图1)。
2.1.2 表达TLR1、TLR 3、TLR 4、TLR 6的hPDLSCs阳性细胞百分比的比较 选取转录水平表达较高的TLR1、TLR 3、TLR 4、TLR 6, 应用流式细胞术对表达TLR1、TLR 3、TLR 4、TLR 6的hPDLSCs的百分比进行检测。由于TLR1、TLR2或TLR2、TLR 6经常会形成异源二聚体来发挥作用, 因此用流式细胞术检测了来源于3个人的hPDLSCs上TLR1、TLR 3、TLR 4、TLR 6的表达, 同时也检测了TLR2的阳性细胞百分比(TLR1: 2.82%± 0.68%; TLR2: 1.26%± 0.09%; TLR3: 13.23%± 2.05%; TLR4: 3.64%± 0.79%; TLR6: 3.21%± 1.64%) , 图2A为代表性实验结果, 图2B为TLR阳性细胞百分比统计图, 结果源于3次独立实验。
hPDLSCs进行成骨诱导培养, 培养液中加入不同浓度TLR1/2的配体Pam3CSK4, TLR3的配体PolyI:C, TLR4的配体LPS, TLR2/6的配体FSL-1, 诱导7 d后进行ALP染色及活性检测。
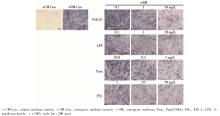
ALP染色:hPDLSCs成骨诱导培养7 d后, 阳性对照组的ALP染色呈蓝色, 实验组加入较高浓度TLR配体时, 染色明显变浅。阴性对照组ALP染色明显浅于诱导组, 呈阴性或弱阳性。
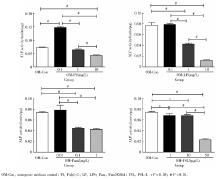
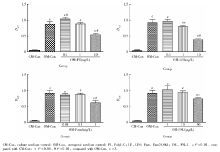
ALP活性检测:hPDLSCs成骨诱导培养7 d后, 相对于阳性对照组, 实验组在较高浓度的TLR配体刺激下, ALP活性显著下调。用TLR3配体PolyI:C(0.1 mg/L)刺激时ALP活性相对于阳性对照组明显上调。茜素红矿化结节染色及半定量分析:hPDLSCs成骨诱导培养14 d后, 阴性对照不染色或呈弱阳性染色; 阳性对照组染色呈红色, 镜下可见散在的红色矿化结节。相对于阳性对照组, 实验组在较高浓度TLR配体刺激下, 茜素红染色显著变浅。半定量分析结果与染色结果相符合。
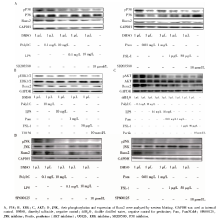
经TLR配体及抑制剂处理的hPDLSCs成骨诱导培养7 d后, 提取蛋白进行Western blotting分析, 发现相对于阳性对照组, 高浓度的TLR配体刺激可明显下调Runx2的表达, 同时ERK、P38、JNK、AKT磷酸化水平均明显下调, 应用10 μ mol/L U0126 (ERK抑制剂)、10 μ mol/L SP600125 ( JNK抑制剂)、10 μ mol/L SB203580 ( P38抑制剂)、5 μ mol/L perifosine (AKT抑制剂)刺激hPDLSCs, Runx2的表达也显著下调(图8)。
牙周膜干细胞来源于牙周组织, 由于其易获得性及良好的多项分化特性, 对于牙周组织及牙齿的修复再生具备良好的临床应用前景, 因此备受关注。Toll样受体是一类跨膜受体, 通过识别病原微生物特定的分子模式, 在免疫调节中发挥重要的作用。TLR不仅表达于免疫细胞, 在许多其他细胞中都有表达, 包括上皮细胞、心肌细胞和间充质干细胞等[4]。许多研究团队对于不同来源的人间充质干细胞上TLR的表达均有报道[8], 如骨髓、脂肪组织、脐带血、牙髓等, 大多认为TLR1~TLR6是普遍表达的, 但TLR7~TLR10的报道却不甚一致, 并且人和小鼠的表达状况也存在差异[9, 10, 11]。此外, 同一来源的间充质干细胞由于同种异体的差异, 提取方法及培养条件的不同, TLR在其上的表达结果也不一致, 如Delarosa等[9]发现低氧可升高人MSC上TLR1、TLR2、TLR5、TLR9、TLR10的表达, 然而, Tomchuck等[12]却发现低氧并不影响TLR的表达。本研究探讨了TLR在hPDLSCs的表达, 发现转录水平TLR1、TLR3、TLR4、TLR6在hPDLSC上有较高的表达, 而TLR7、TLR8、TLR10表达很低, 这与Li等[13]的结果基本一致。此外, 之前关于TLR表达的研究数据多源于转录水平, 本研究应用流式细胞术检测了表达TLR1、TLR2、TLR3、TLR4、TLR6的hPDLSCs的阳性细胞百分比, 说明了TLR1、TLR2、TLR3、TLR4、TLR6在hPDLSCs上的组成性表达情况, 其中TLR3阳性的hPDLSCs细胞百分比相对较高, 而TLR2的阳性细胞百分比相对较低, 与转录水平TLR表达的结果相一致。
近来的研究表明, TLR对间充质干细胞的成骨分化功能具有调节作用, Pevsner-Fischer等[10]发现Pam3Cys可抑制间充质干细胞的成骨及成软骨分化; Hwa Cho等[14]报道了LPS和PGN(peptidoglycan)可刺激脂肪干细胞成骨分化, 认为PolyI:C本身对成骨成脂分化没有影响, 但却可以和LPS或PGN协同刺激成骨, 而CpG oligodeoxynucleotides (CpG-ODN)可降低脂肪干细胞成骨, 并且LPS 和PGN的成骨作用伴随ERK的活化。另有报道发现LPS抑制成骨, 并造成骨量丢失, MAPK信号通路被认为与成骨过程相关, Yagi等[15]发现低氧环境可通过影响ERK, P38 MAPK的活化来改变PDLSC的成骨分化; Kim等[16]发现海藻糖可以通过活化JNK和ERK依赖的BMP2-Smad1/5/8信号通路促进人骨髓间充质干细胞的成骨; 此外有研究表明[17, 18, 19], AKT是TLR下游重要的信号分子, 而AKT的磷酸化在间充质干细胞成骨过程中也发挥十分重要的作用。总之, MAPK和AKT通路在间充质干细胞的成骨过程中发挥重要的作用。MAPK和AKT位于TLR下游, 已有研究表明[5, 6, 7], 它们会影响细胞增殖、存活和组织修复过程。目前, 针对TLR对hPDLSCs成骨分化影响的研究尚不多见, 其分子机制也不明了。有研究发现TLR对间充质干细胞成骨分化有影响, 但结果不甚一致, 可能的影响因素与细胞的来源、种属、培养条件及TLR配体的刺激浓度不同有关[4]。本研究检测了TLR对hPDLSCs早、中、晚期各阶段成骨的影响, 并且应用不同浓度TLR配体(PolyI:C、LPS、Pam3CSK4及FSL-1)刺激hPDLSCs后观察成骨的变化, 发现低浓度PolyI:C可以促进成骨, 而较高浓度的TLR配体可以抑制成骨分化, 还发现高浓度的TLR配体刺激可抑制hPDLSCs的Runx2表达, 并可下调MAPK和AKT的磷酸化, 应用ERK、P38、JNK、AKT抑制剂处理hPDLSCs均可抑制其Runx2的表达, 因而TLR配体对hPDLSCs这种成骨的抑制作用可能和TLR下游MAPK及AKT磷酸化下调有关。
本研究应用高、低浓度的TLR1和TLR2配体Pam3CSK4处理hPDLSCs时, 磷酸化的P38和AKT下调, 但变化趋势与配体浓度趋势不一致, 可能配体刺激浓度引起的P38及AKT磷酸化的改变不是引起Runx2改变的唯一原因, 还可能受其他通路的交叉影响, 尚待进一步实验证明。本研究探讨了TLR对hPDLSCs成骨的影响并推测了可能的机制, 但具体以上提及的信号通路如何发挥作用, 以及是否与其他成骨相关的通路形成交叉均有待进一步验证。此外, 本研究的结果显示TLR配体刺激在低浓度时不影响hPDLSCs的成骨分化, 或者具有促进成骨分化的作用, 如PolyI:C (TLR3配体), 说明TLR配体浓度对hPDLSCs成骨影响很大, 但就TLR配体浓度的改变如何影响hPDLSCs的成骨及其分子机制尚需更多实验加以探讨。
免疫微环境对干细胞功能影响是目前干细胞的一大研究热点, 牙周炎疾病过程中, 牙周致病菌及代谢物可作为TLR的配体, 作用于牙周组织中牙周膜干细胞所处的炎症微环境, 对其功能进行调节。本研究检测了TLR在hPDLSCs的表达, 并且发现高浓度的TLR可抑制hPDLSCs的成骨, 这种抑制作用可能和MAPK及AKT磷酸化的下调有关。本课题组将进一步探讨TLR信号通路MAPK和AKT分子上游信号的改变, 以及与成骨相关的其他信号通路是否有交叉, 明确TLR影响hPDLSCs成骨分化的分子机制, 为牙周膜干细胞应用于临床牙周炎组织再生及修复提供一定的理论依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|