1 资料与方法
1.1 一般资料
1.2 检测方法
1.2.1 粪便菌群分析(16S rRNA测序)
1.2.2 高通量测序数据分析
1.3 微生物菌群分析方法
1.4 统计学方法
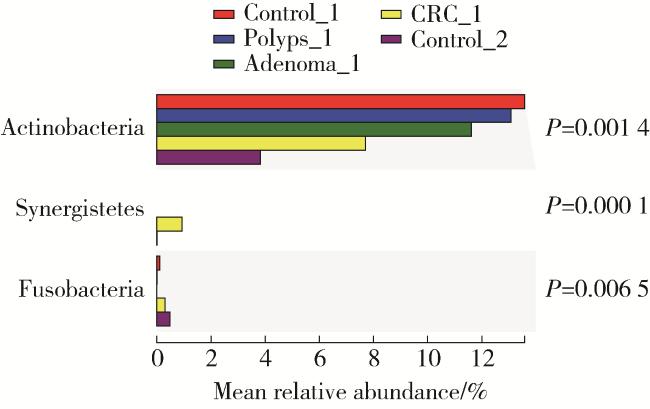
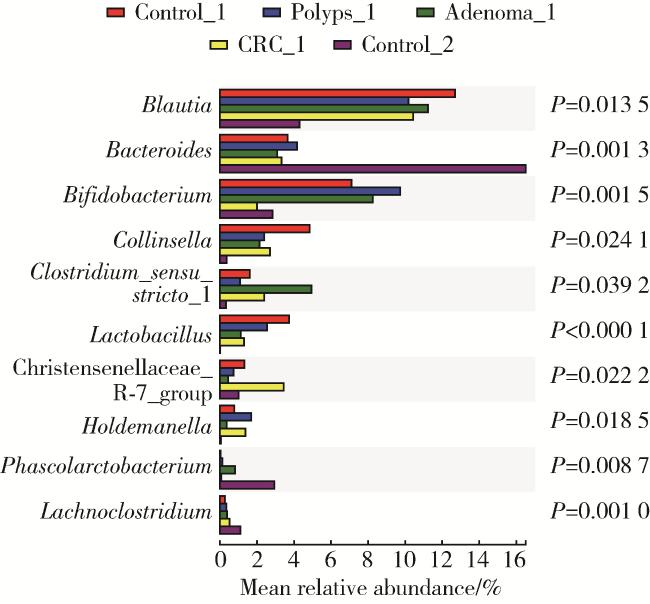
2 结果
2.1 研究对象的一般情况
表1 研究对象的一般情况Table 1 General information about the study subjects |
| Items | High-altitude group | Low-altitude control (n=17) | P value | |||
| Control (n=29) | Non-adenomatous polyp (n=12) | Adenoma (n=10) | Colorectal cancer (n=10) | |||
| Gender, n (%) | ||||||
| Male | 15 (51.7) | 5 (41.7) | 5 (50.0) | 3 (30.0) | 8 (47.1) | 0.813 |
| Female | 14 (48.3) | 7 (58.3) | 5 (50.0) | 7 (70.0) | 9 (52.9) | |
| Age/years, $\bar x \pm s$ | 40.38±13.76 | 48.33±15.59 | 49.90±8.13 | 55.30±11.26 | 41.53±11.05 | 0.011 |
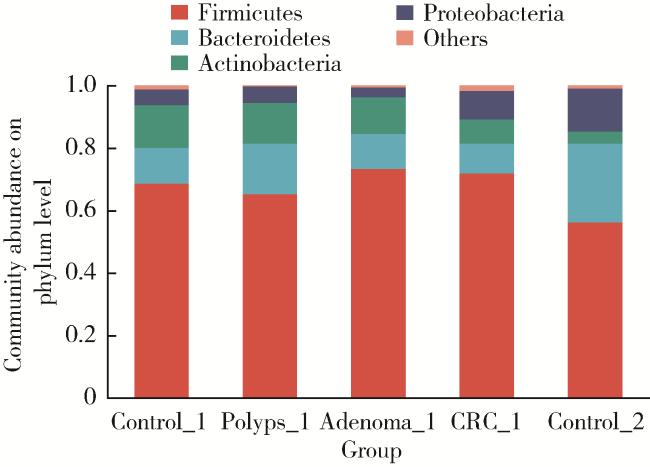
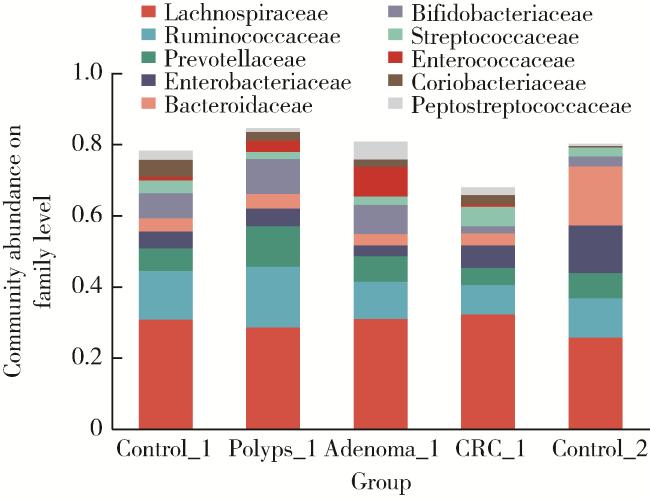
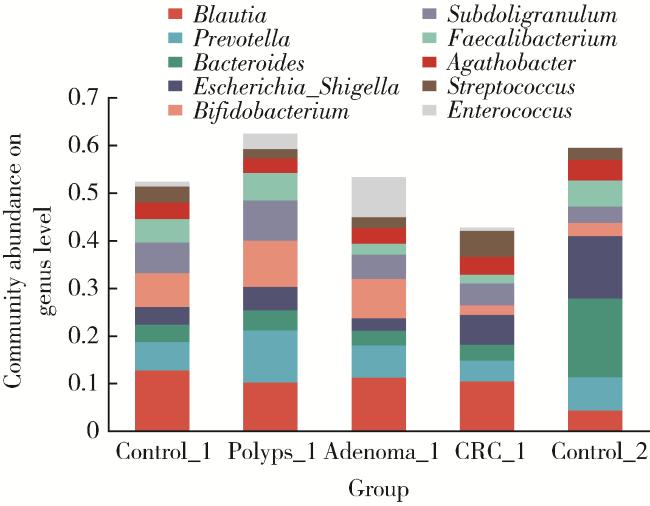
2.2 物种多样性分析
表2 α多样性检验结果Table 2 The results of alpha diversity test |
| Index | High-altitude group | Low-altitude control (n=17) | |||
| Control (n=29) | Non-adenomatous polyp (n=12) | Adenoma (n=10) | Colorectal cancer (n=10) | ||
| Sobs | 167.6±53.52 | 160.7±45.3 | 167.8±65.9 | 207.7±57.8 | 155.0±59.4 |
| Shannon | 2.814±0.755 | 2.871±0.542 | 2.793±1.026 | 3.376±0.499 | 2.814±0.755 |
| Ace | 196.9±59.5 | 191.7±53.2 | 198.8±66.8 | 234.9±63.6 | 175.8±63.9 |
Data are expressed as $\bar x \pm s$. |
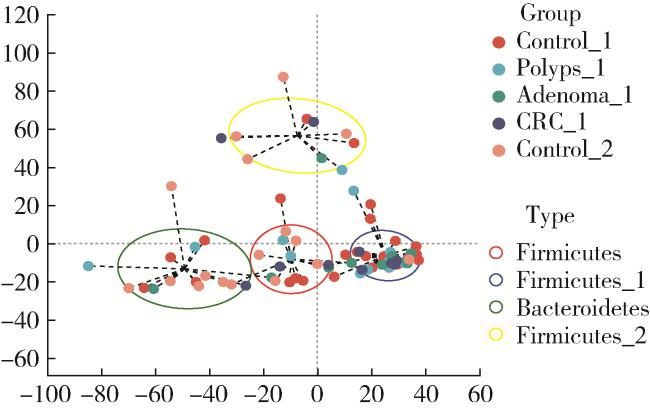
图1 各组间肠型聚类分析Figure 1 Analysis of enterotypes among groups X-axis and Y-axis are distance matrices calculated based on PCoA, indicating the two selected principal component axes, and the percentage indicates the value of the degree of explanation of the differences in the composition of the samples by the principal components; the scales of the X-axis and the Y-axis are relative distances without any practical significance. Control_1, high-altitude control; Polyps_1, high-altitude non-adenomatous polyp; Adenoma_1, high-altitude adenoma; CRC_1, high-altitude colorectal cancer; Control_2, low-altitude control. |