1 材料与方法
1.1 秀丽隐杆线虫株
表1 AD模型线虫株基因型及其表型Table 1 Information of AD model Caenorhabditis elegans strains |
| Strain | Genotype | Description |
| CL2006 | dvIs2 [pCL12(unc-54/human Aβ peptide 1-42 minigene)+rol-6(su1006)] | Adult onset paralysis and egg-laying deficiency |
| CL2355 | dvIs50 [pCL45 (snb-1:: Abeta 1-42:: 3′ UTR(long)+mtl-2:: GFP] Ⅰ | Pan-neuronal expression of human Aβ peptide. Strain shows deficits in chemotaxis, associative learning, and thrashing in liquid |
| CL4176 | dvIs27 [myo-3p: : Abeta (1-42): : let-851 3′UTR)+rol-6(su1006)] Ⅹ | Adult onset paralysis quickly |
1.2 实验试剂
1.3 线虫的培养与同步化处理
1.4 实验药物与分组
1.5 线虫寿命试验
1.6 线虫运动能力测定
1.7 线虫的化学物质趋向性介导的联合型学习能力测定
1.8 线虫体内Aβ蛋白表达量变化
1.9 活性氧(reactive oxygen species, ROS)含量检测
1.10 RT-qPCR检测skn-1、daf-16等基因
1.11 统计学分析
2 结果
2.1 ESC与DEX对AD模型线虫寿命的影响
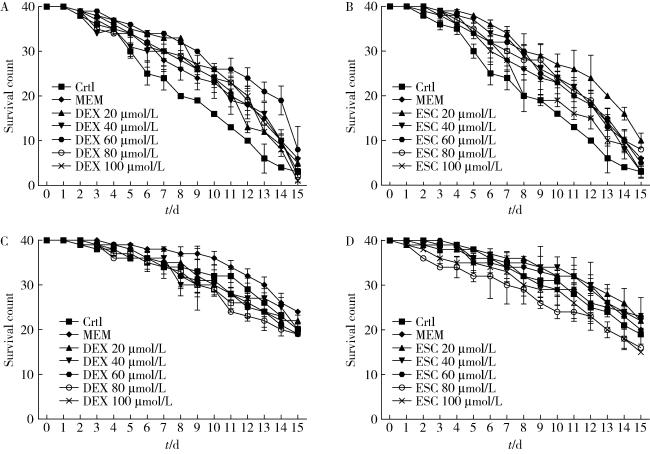
图1 不同剂量下ESC与DEX干预组CL2006模型和野生型N2线虫存活数量Figure 1 Survival count of CL2006 and N2 in different doses of escin (ESC) and dextromethor phan (DEX) Survival count of Alzheimer disease (AD) model CL2006 and N2 C. elegans after different drug treatments. Survival count of CL2006 after different doses of DEX (A) or ESC (B) treatment; survival count of N2 after different doses of DEX (C) or ESC (D) treatment. MEM, memantine. *P < 0.05 compared with control (Crtl). n=3. |
表2 ESC与DEX处理CL2006线虫的生存时间变化Table 2 Survival time of CL2006 under different concentrations of escin and dextromethorphan |
| Items | Concentration/(μmo/L) | Sample size,n | Medium lifespan/d | Mean lifespan/d, ${\bar x}$±s |
| Crtl | 40 | 8.00 | 14.71±0.23 | |
| MEM | 40 | 11.00 | 20.41±0.25 | |
| ESC | 20 | 40 | 15.00 | 25.13±0.71 |
| 40 | 40 | 13.00 | 20.93±0.63 | |
| 60 | 40 | 13.00 | 20.73±0.54 | |
| 80 | 40 | 13.00 | 21.49±0.42 | |
| 100 | 40 | 8.00 | 17.54±0.46 | |
| DEX | 20 | 40 | 11.00 | 20.60±0.14 |
| 40 | 40 | 11.00 | 21.16±0.23 | |
| 60 | 40 | 13.00 | 25.20±0.47 | |
| 80 | 40 | 11.00 | 20.59±0.25 | |
| 100 | 40 | 12.00 | 20.38±0.58 |
Crtl, control group; MEM, memantine; DEX, dextromethorphan; ESC, escin. Mean lifespan=∑(number of surviving nematodes at each time point × days) / total number of nematodes. |
2.2 ESC与DEX对线虫运动能力的影响
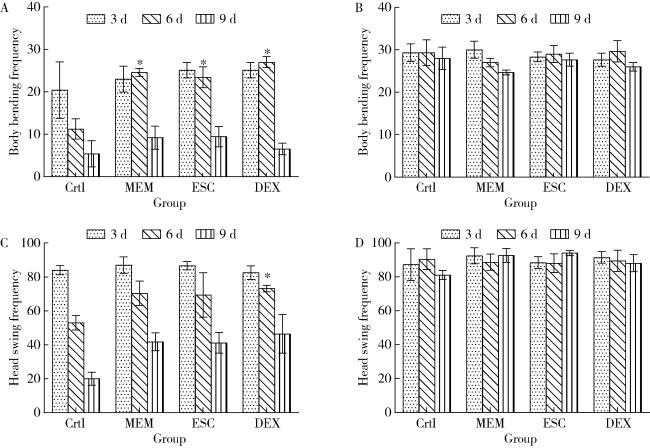
图2 ESC与DEX对线虫活动能力的影响Figure 2 Effects of escin and dextromethorphan on nematode activity Effects on nematode activity post 3-to 9-day treatment of ESC or DEX. A and B, body bending frequency of AD model CL4176 (A) and N2 (B) C. elegans; C and D, head swing frequency of CL4176 (C) and N2 (D) C. elegans. Crtl, control; MEM, memantine; DEX, dextromethorphan; ESC, escin. *P < 0.05 compared with control. n=3. |
2.3 ESC和DEX对线虫趋化实验认知能力的影响
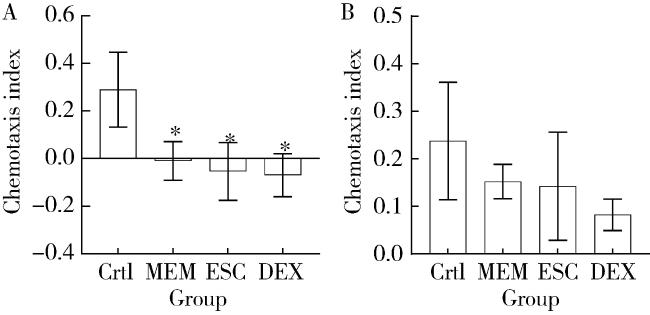
图3 ECS与DEX处理对线虫趋化指数的影响Figure 3 Effects of escin and dextromethorphan on the chemotaxis index of Caenorhabditis elegans Effects of ESC and DEX on the chemotaxis index of AD model (A) and normal N2 (B) C. elegans strains. A and B represent chemotaxis index of AD model CL2355 and normal N2 C. elegans. Crtl, control; MEM, memantine; DEX, dextromethorphan; ESC, escin. *P < 0.05, compared with control ESC. n=3. |
2.4 AD模型线虫体内Aβ蛋白含量变化检测
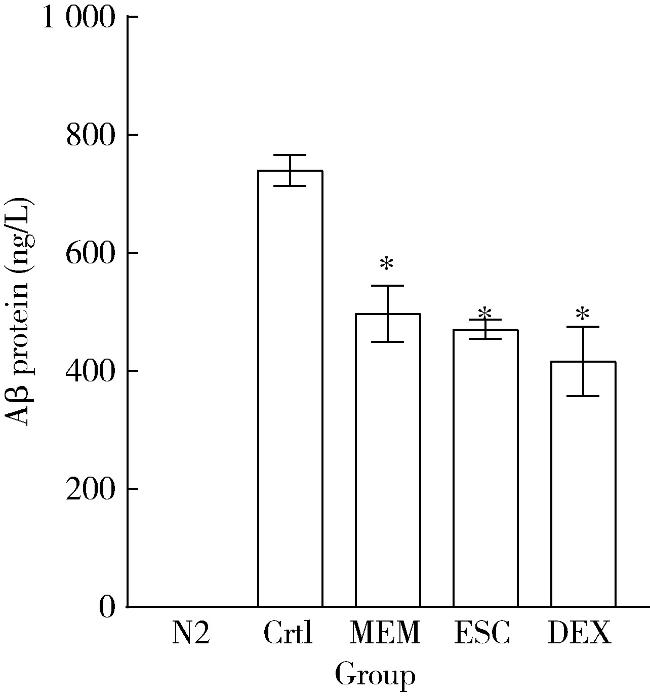
图4 各组AD模型线虫中Aβ蛋白含量变化Figure 4 Changes of Aβ protein content in AD model Caenorhabditis elegans in each groups Changes of Aβ protein content in AD model CL2006 C. elegans. CL2006 worms were treated with ESC, DEX, or MEM followed by measurement of Aβ levels. Normal N2 worms were included for comparison. Crtl, control; MEM, memantine; DEX, dextromethorphan; ESC, escin. *P < 0.05, compared with control. n=3. |
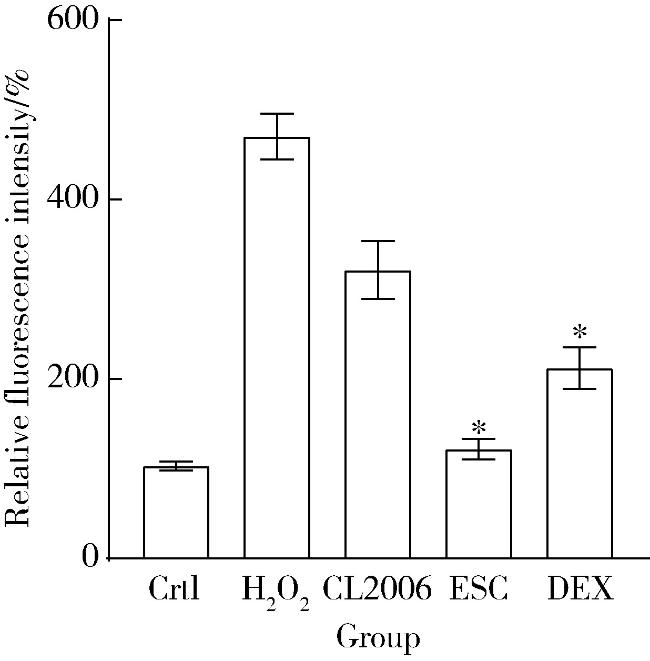
2.5 AD模型线虫干预组降低ROS含量
2.6 对氧化应激相关通路基因的影响
表3 各干预组中基因mRNA表达情况Table 3 mRNA expression in each intervention group |
| Items | skn-1 | daf-16 | daf-2 | sod-2 | jjk-1 | aak-2 |
| Crtl | 1.0±0.1 | 1.0±0.2 | 1.0±0.0 | 1.0±0.0 | 1.0±0.1 | 1.0±0.1 |
| MEM | 1.1±0.0 | 0.9±0.2 | 1.1±0.2 | 1.3±0.2 | 1.2±0.0 | 1.1±0.0 |
| ESC | 1.9±0.2* | 1.1±0.1 | 1.2±0.1 | 1.1±0.1 | 1.2±0.2 | 1.1±0.1 |
| DEX | 1.1±0.1 | 0.9±0.1 | 0.8±0.1 | 0.9±0.1 | 0.8±0.1 | 0.9±0.2 |
Data were ${\bar x}$±s. n=3. Crtl, control;MEM, memantine;DEX, dextromethorphan;ESC, escin. *P < 0.05,compared with control. |