1 资料与方法
1.1 纳入与排除标准
1.2 研究分组
1.3 ART治疗流程
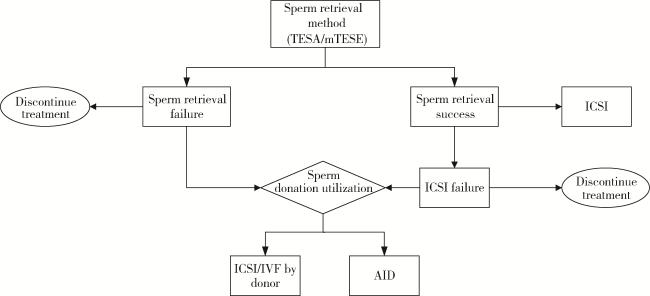
图1 NOA患者治疗决策流程图Figure 1 Treatment decision flowchart for NOA patients Patients diagnosed with nonobstructive azoospermia (NOA) begin clinical management with surgical sperm retrieval procedures, either percutaneous testicular sperm aspiration (TESA) or microdissection testicular sperm extraction (mTESE). Following the retrieval outcome, those who successfully obtain sperm proceed directly to intracytoplasmic sperm injection (ICSI) using autologous sperm. If sperm retrieval fails, patients may choose artificial insemination by donor (AID) or opt for donor sperm in vitro fertilization (IVF)/intracytoplasmic sperm injection (ICSI). In cases where these treatments are unsuccessful, patients face further decisions, including abandoning treatment entirely or reattempting donor sperm assisted reproductive technology (ART) cycles. Importantly, treatment discontinuation may occur at any stage due to patient preferences (e. g., refusal to continue after initial attempt to retrieve autologous sperm), financial constraints, or medical advice (e. g., halting treatment following repeated ART/AID failures). |
1.4 统计学方法
2 结果
2.1 患者基线信息
表1 NOA患者基线信息Table 1 Baseline information of NOA patients |
| Parameters | Total (n=1 730) | Fresh sperm with synchronous ART | Frozen-thawed sperm with non-synchronous ART | |||
| Fresh mTESE (n=696) | Fresh TESA (n=632) | Thawed mTESE (n=392) | Thawed TESA (n=10) | |||
| Age/years, ${\bar x}$±s | 30.43±4.21 | 29.76±3.97 | 30.79±4.33 | 30.97±4.22 | 32.7±5.66 | |
| BMI/(kg/m2), ${\bar x}$±s | 25.57±3.89 | 25.46±4.07 | 25.38±3.63 | 26.03±3.91 | 26.97±4.48 | |
| Testicle volume/mL, ${\bar x}$±s | ||||||
| Left | 8.73±5.54 | 5.49±3.96 | 13.49±4.27 | 6.64±4.11 | 15.10±4.43 | |
| Right | 8.82±5.55 | 5.57±3.93 | 13.65±4.21 | 6.64±4.16 | 14.60±5.28 | |
NOA, nonobstructive azoospermia; mTESE, microdissection testicular sperm extraction; TESA, percutaneous testicular sperm aspiration; BMI, body mass index. |
2.2 不同取精方式对患者选择精子库供精的影响
表2 不同取精方式对应患者例数Table 2 Case numbers of patients corresponding to different sperm retrieval methods |
| Sperm source | Fresh sperm with synchronous ART | Frozen-thawed sperm with non-synchronous ART | Total | |||
| Fresh mTESE | Fresh TESA | Thawed mTESE | Thawed TESA | |||
| Total | 696 | 632 | 392 | 10 | 1 730 | |
| Paternal | 533 | 599 | 369 | 10 | 1 511 | |
| Donor | 163 | 33 | 23 | 0 | 219 | |
| Donor proportion | 23.42% | 5.22% | 5.87% | 0.00% | 12.66% | |
ART, assisted reproductive technology; mTESE, microdissection testicular sperm extraction; TESA, percutaneous testicular sperm aspiration. |
表3 对数线性模型饱和模型结果Table 3 Log-linear model saturated model results |
| Parameters | Estimate (95%CI) | SE | Z | P |
| Whether fresh or frozen-thawed×Sperm retrieval method×Sperm source | -0.177 (-0.538, 0.185) | 0.185 | -0.957 | 0.339 |
| Whether fresh or frozen-thawed×Sperm retrieval method | -0.743 (-1.105, -0.381) | 0.185 | -4.025 | <0.001 |
| Whether fresh or frozen-thawed×Sperm source | -0.217 (-0.578, 0.145) | 0.185 | -1.173 | 0.241 |
| Sperm retrieval method×Sperm source | -0.249 (-0.611, 0.113) | 0.185 | -1.349 | 0.177 |
| Whether fresh or frozen-thawed | 1.320 (0.958, 1.681) | 0.185 | 7.150 | <0.001 |
| Sperm retrieval method | 1.110 (0.748, 1.472) | 0.185 | 6.014 | <0.001 |
| Sperm source | 1.233 (0.872, 1.595) | 0.185 | 6.683 | <0.001 |
表4 对数线性模型简约模型结果Table 4 Log-linear model reduced model results |
| Parameters | Estimate (95%CI) | SE | Z | P |
| TESA×Paternal source | 2.780 (2.359, 3.202) | 0.215 | 12.941 | <0.001 |
| TESA×Donor source | Reference | |||
| mTESE×Paternal source | 4.499 (3.925, 5.072) | 0.293 | 15.37 | <0.001 |
| mTESE×Donor source | Reference |
TESA, percutaneous testicular sperm aspiration; mTESE, microdissection testicular sperm extraction. |