1 材料与方法
1.1 在线生物信息的提取
1.2 实验动物、试剂与仪器
1.3 SS大鼠模型的制备
1.4 实验的分组和处理
1.5 各组大鼠唾液分泌量的检测
1.6 各组大鼠颌下腺组织病理活检
1.7 大鼠血清中TNF-α和IL-1β含量的检测
1.8 大鼠颌下腺组织中差异基因的高通量测序
1.9 大鼠颌下腺组织中AQP5、TLR4、MyD88、NF-κB的mRNA表达
表1 各基因的引物序列Table 1 Primer sequence of each gene |
| Gene | Sequence | |
| rno-AQP5 | Forward | GGACCTGACCTGCCGTCTAG |
| Reverse | TAGCCCAGGATGCCCTTGAG | |
| rno-TLR4 | Forward | CCATGAGGCACATTGTTACG |
| Reverse | AAGTGCTTCACCACCTGCTT | |
| rno-MyD88 | Forward | CTAGCGACAAGCCATACACG |
| Reverse | GTAGCCGAATCGTAGCCAGA | |
| rno-NF-κB | Forward | GTGGGTTCAGATGAGGAGGA |
| Reverse | TCTGGTCCAAATAGGCTTGG | |
| rno-GAPDH | Forward | TGTAATAATTGTAGCCAAGTAAATCTCC |
| Reverse | AAGTAACCATTTTTCAAAACATTCAAG |
rno, Rattus norvegicus; AQP5, aquaporin 5; TLR4, Toll-like receptor 4; MyD88, myeloid differentiation factor 88; NF-κB, nuclear factor κB; GAPDH, glyceraldehydes3-phosphate dehydrogenase. |
1.10 Western blot检测大鼠颌下腺组织中AQP5、TLR4、MyD88、NF-κB的蛋白表达
1.11 统计学分析
2 结果
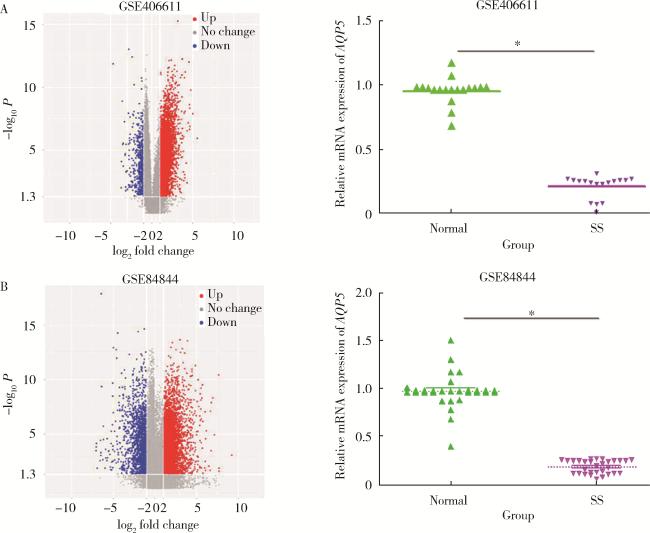
2.1 AQP5在SS患者中的表达
图1 在线分析AQP5基因在SS患者中的表达Figure 1 Online analysis of the expression of AQP5 gene in SS patients A, the volcanic diagram of differentially expressed genes and expression of AQP5 gene in dataset GSE406611; B, the volcanic diagram of differentially expressed gene and expression of AQP5 gene in dataset GSE84844. * P < 0.05. SS, Sjögren syndrome; AQP5, aquaporin 5. |
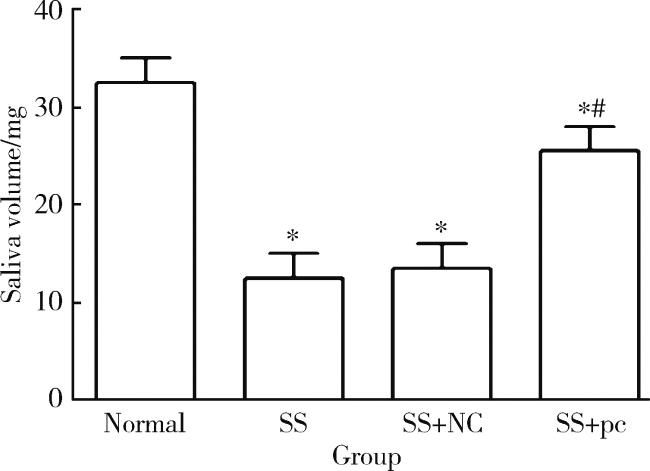
2.2 各组大鼠造模状态以及唾液分泌量的比较
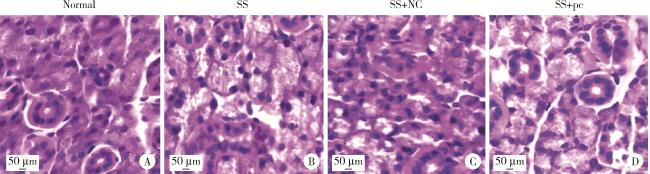
2.3 各组大鼠颌下腺组织损伤的病理比较
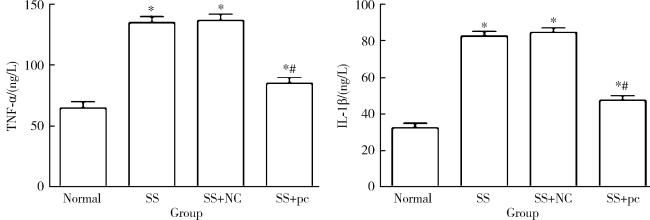
2.4 各组大鼠血清中炎性因子TNF-α和IL-1β的含量
图4 各组大鼠血清中TNF-α和IL-1β的含量比较Figure 4 The comparison of the levels of TNF-α and IL-1β in serum of rats in each group * P < 0.05, compared with the Normal group; # P < 0.05, compared with the SS group. SS, Sjögren syndrome; NC, negative control; pc, rno-pcDNA3.1-AQP5; TNF-α, tumor necrosis factor-α; IL-1β, interleukin-1β. |
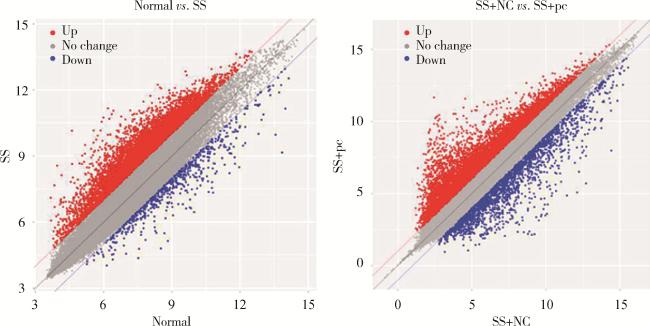
2.5 大鼠颌下腺组织差异表达基因的高通量测序结果
表2 上调和下调表达前10位的基因Table 2 Top 10 genes of up-regulated and down-regulated expression |
| Normal vs. SS | SS+NC vs. SS+pc | |||||||
| Up-regulated | Score | Down-regulated | Score | Up-regulated | Score | Down-regulated | Score | |
| rno-TLR4 | 0.993 4 | rno-AQP5 | 0.998 2 | rno-AQP5 | 0.999 3 | rno-TLR4 | 0.998 7 | |
| rno-MyD88 | 0.990 3 | rno-ALOX15B | 0.976 1 | rno-AGTR1 | 0.976 4 | rno-MyD88 | 0.973 4 | |
| rno-NF-κB | 0.985 1 | rno-ADCY7 | 0.962 5 | rno-AGTR2 | 0.951 7 | rno-NF-κB | 0.950 5 | |
| rno-ATIC | 0.963 7 | rno-CACNA1S | 0.948 9 | rno-CALCA | 0.934 8 | rno-SPP1 | 0.893 9 | |
| rno-BDKRB1 | 0.952 9 | rno-CAMK2B | 0.930 3 | rno-CAT | 0.930 5 | rno-SIRT1 | 0.891 6 | |
| rno-CCL2 | 0.941 8 | rno-NCAM1 | 0.922 9 | rno-NOS1 | 0.915 3 | rno-TLR2 | 0.887 2 | |
| rno-CCR5 | 0.930 7 | rno-NADK | 0.917 7 | rno-NOS2 | 0.909 1 | rno-HTRIA | 0.885 7 | |
| rno-IRF4 | 0.922 4 | rno-MED1 | 0.901 4 | rno-NR3C1 | 0.893 3 | rno-GRM5 | 0.876 1 | |
| rno-JUN | 0.913 8 | rno-MC4R | 0.899 0 | rno-MTOR | 0.877 2 | rno-GNAT3 | 0.863 9 | |
| rno-LCK | 0.892 9 | rno-NCOA1 | 0.887 3 | rno-KIT | 0.861 7 | rno-ESR1 | 0.852 8 | |
SS, Sjögren syndrome; NC, negative control; pc, rno-pcDNA3.1-AQP5; TLR4, Toll-like receptor 4; MyD88, myeloid differentiation factor 88; NF-κB, nuclear factor κB; ATIC, aminoimidazole carboxamide ribonucleotide transformylase; BDKRB1, bradykinin receptor B1; CCL2, CC chemokine ligand 2; CCR5, CC chemokine receptor 5; IRF4, interferon regulatory factor 4; JUN, c-jun; LCK, lymphocyte cell kinase; AQP5, aquaporin 5; ALOX15B, acid lipoxygenase 15B; ADCY7, adenylyl cyclase 7; CACNA1S, calcium channel, voltage-dependent, L-type, alpha 1S subunit; CAMK2B, calmodulin-dependent protein kinase 2b; NCAM1, neural cell adhesion molecule1; NADK, NAD kinase; MED1, mediator subunit 1; MC4R, melanocortin-4 receptor; NCOA1, nuclear receptor coactivator 1; AGTR1, angiotensin Ⅱ type 1 receptor; AGTR2, angiotensin Ⅱ type 2 receptor; CALCA, calcitonin-related peptide; CAT, catalase; NOS1, nitric oxide synthase 1; NOS2, nitric oxide synthase 2; NR3C1, glucocorticoid receptor; MTOR, mammalian target of rapamycin; KIT, c-kit; SPP1, secreted phosphoprotein 1; SIRT1, silent information regulation 1; TLR2, Toll-like receptor 2; HTRIA, hydroxytryptamin; GRM5, glutamate receptor, metabotropic 5; GNAT3, guanine nucleotide binding protein alpha transducing 3; ESR1, estrogen receptor alpha. |
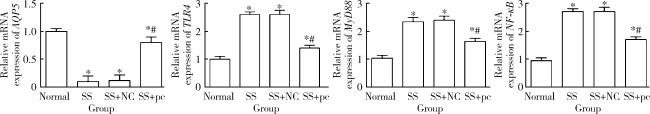
2.6 各组大鼠颌下腺组织中rno-AQP5、rno-TLR4、rno-MyD88、rno-NF-κB的mRNA表达
图6 各组大鼠颌下腺组织中rno-AQP5、rno-TLR4、rno-MyD88、rno-NF-κB的mRNA表达Figure 6 The mRNA expression of rno-AQP5, rno-TLR4, rno-MyD88, and rno-NF-κB in the submandibular gland tissue of each group of rats * P < 0.05, compared with the Normal group; # P < 0.05, compared with the SS group. SS, Sjögren syndrome; NC, negative control; pc, rno-pcDNA3.1-AQP5; rno, Rattus norvegicus; AQP5, aquaporin 5; TLR4, Toll-like receptor 4; MyD88, myeloid differentiation factor 88; NF-κB, nuclear factor κB. |
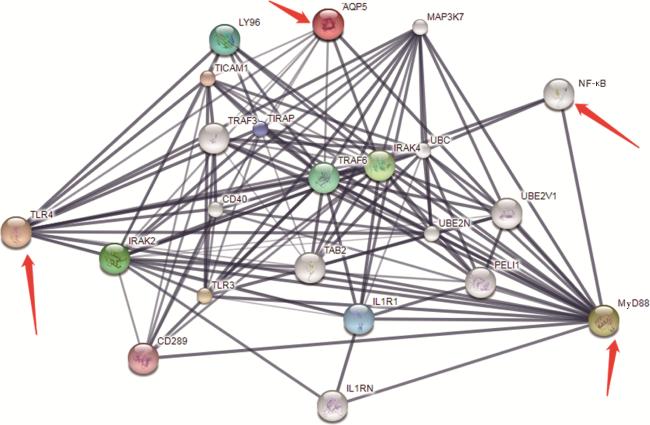
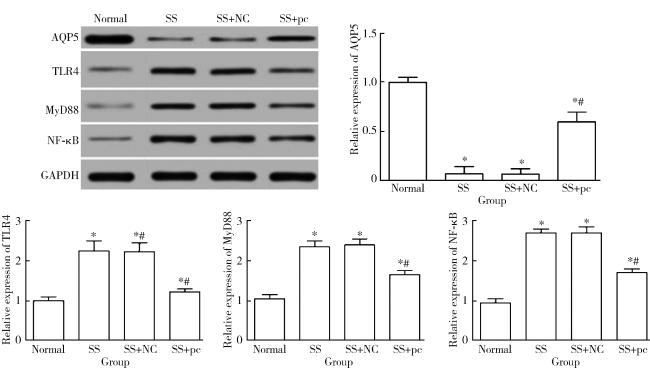
2.7 各组大鼠颌下腺组织中AQP5、TLR4、MyD88、NF-κB的表达
图7 AQP5、TLR4、MyD88、NF-κB之间的作用网络Figure 7 Interaction network among AQP5, TLR4, MyD88, and NF-κB AQP5, aquaporin 5; TLR4, Toll-like receptor 4; MyD88, myeloid differentiation factor 88; NF-κB, nuclear factor κB; IRAK2, interleukin-1 receptor associated kinases 2; CD289, Toll-like receptor 9; TLR3, Toll-like receptor 3; IL1R1, interleukin 1 receptor type Ⅰ; TAB2, TAK1 binding protein 2; IL1RN, interleukin-1 receptor antagonist; PELI1, pellino-1; UBE2N, ubiquitin-conjugating enzyme E2 N; UBC, ubiquitin-conjugating enzyme; LY96, lymphocyte antigen 96; TICAM1, Toll interleukin-1 receptor domain containing adaptor molecule 1; TRAF3, tumor necrosis factor-associated factor 3; TIRAP, Toll interleukin-1 receptor domain containing adaptor protein; CD40, cluster of differentiation 40; TRAF6, tumor necrosis factor-associated factor 6; IRAK4, interleukin-1 receptor associated kinases 4; UBE2V1, ubiquitin conjugating enzyme E2 V1; MAP3K7, mitogen-activated protein kinase kinase kinase 7. |