1 资料与方法
1.1 临床资料及样本收集
1.2 唾液外泌体的提取及鉴定
1.3 Shotgun质谱分析
1.4 唾液外泌体与佛波酯(phorbol 12-myristate 13-acetate, PMA)诱导的人源单核细胞系(human monocyte leukemia cells,THP-1)细胞共培养模型
1.5 ELISA检测培养上清IL-6、TNF-α、IL-1β水平
1.6 实时定量聚合酶链反应(real-time quantitative PCR,qPCR)检测CD80+和CD86+
表1 实时定量聚合酶链反应扩增所用的基因引物序列Table 1 The sequences of target genes' primers used in qPCR amplification |
| Gene | Forward (5′-3′) | Reverse (5′-3′) |
| CD86+ | CTGCTCATCTATACACGGTTACC | GGAAACGTCGTACAGTTCTGTG |
| CD80+ | GGCCCGAGTACAAGAACCG | TCGTATGTGCCCTCGTCAGAT |
| GAPDH | GGAGCGAGATCCCTCCAAAAT | GGCTGTTGTCATACTTCTCATGG |
qPCR, real-time quantitative PCR; GAPDH, glyceraldehyde-3-phosphate dehydrogenase. |
1.7 统计学分析
2 结果
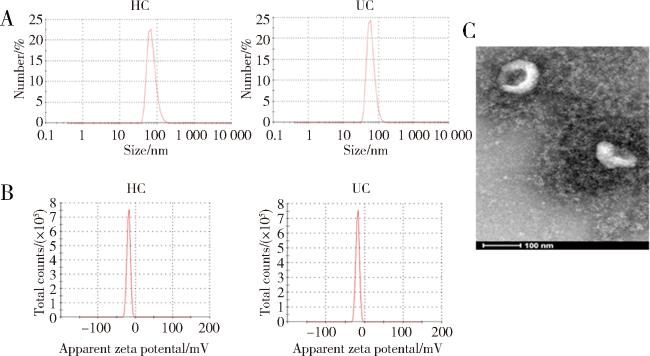
2.1 唾液外泌体验证
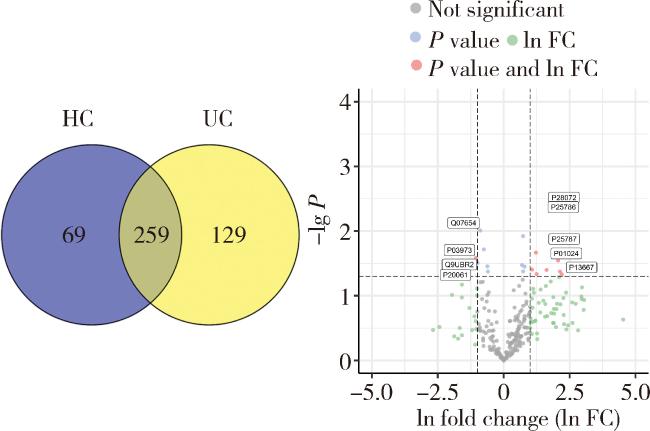
2.2 健康对照组志愿者与溃疡性结肠炎患者中的唾液外泌体蛋白质差异分析
图2 UC组与HC组唾液外泌体蛋白质种类对比Figure 2 Comparison of salivary exosomal proteins between the ulcerative colitis (UC) group and the healthy control (HC) group |
表2 UC组与健康对照组唾液外泌体差异表达的15种蛋白质Table 2 15 differential proteins in salivary exosomes between the UC group and the healthy group |
| Protein ID | Gene | Description | Fuction |
| Up regulated (11) | |||
| P13667 | PDIA4 | Protein disulfide-isomerase A4 | Protein processing in endoplasmic reticulum |
| P01023 | A2M | Alpha-2-macroglobulin | Complement and coagulation cascades |
| P13639 | EEF2 | Elongation factor 2 | Neutrophil degranulation |
| P01024 | C3 | Complement C3 | Complement and coagulation cascades |
| P25787 | PSMA2 | Proteasome subunit alpha type-2 | Proteasome actvities |
| P28072 | PSMB6 | Proteasome subunit beta type-6 | Proteasome activities |
| P25786 | PSMA1 | Proteasome subunit alpha type-1 | Proteasome activities |
| P01857 | IGHG1 | Ig gamma-1 chain C region | Immunoglobulin receptor binding |
| P01860 | IGHG3 | lg gamma-3 chain C region | Immunoglobulin receptor binding |
| P01861 | IGHG4 | Ig gamma-4 chain C region | Immunoglobulin receptor binding |
| B4E1H2 | SERPING1 | Plasma protease C1 inhibitor | Complement and coagulation cascades |
| Down regulated (4) | |||
| P20061 | TCN1 | Transcobalamin-1 | Vitamin binding |
| P03973 | SLPI | Antileukoproteinase | Endopeptidase regulator activity |
| Q9UBR2 | CTSZ | Cathepsin Z | Endopeptidase activity |
| Q07654 | TFF3 | Trefoil factor 3 | Regulation of small molecule metabolic process |
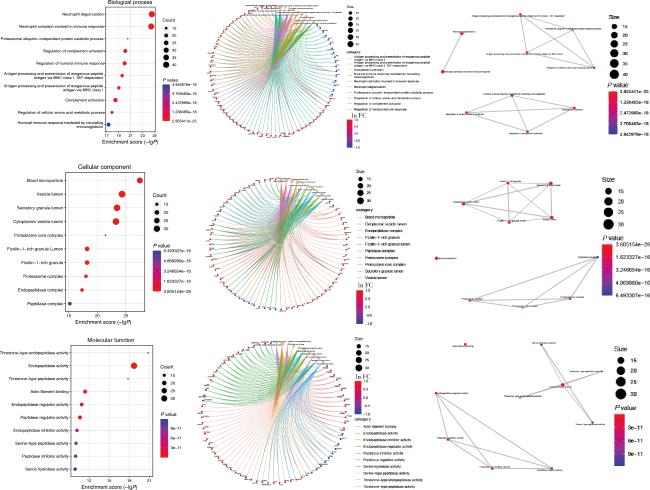
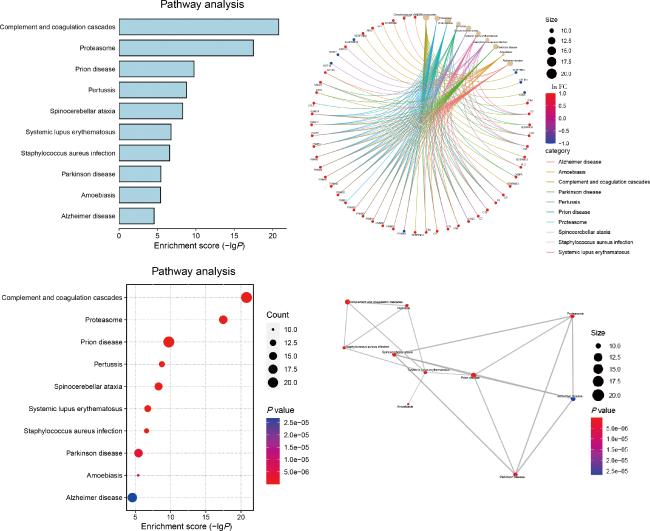
2.3 HC组与UC组唾液外泌体差异蛋白对应基因的GO/KEGG富集分析
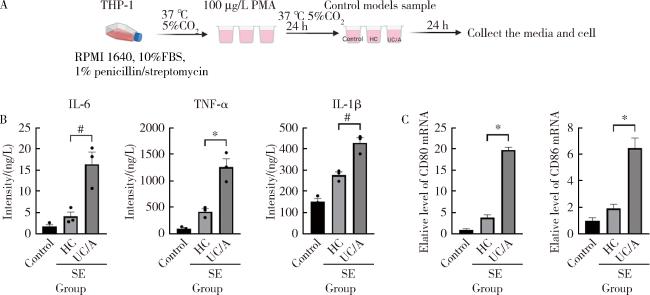
2.4 活动期UC患者唾液外泌体促进巨噬细胞(THP-1)向M1型极化
图5 唾液外泌体在体外对巨噬细胞的作用Figure 5 Effect of salivary exosomes on THP-1 cells in vitro A, co-culture model diagram of human monocyte leukemia cells (THP-1) cells and salivary exosomes; B, expression of inflammatory cytokines in cell culture supernatant detected by ELISA; C, mRNA expression profile of surface markers in M1 macrophages. Control, blank group without exosome stimulation; HC, healthy control; UC/A, active UC patients; SE, salivary exosomes. Data are $\bar x \pm s$, # P < 0.01, *P < 0.001. |